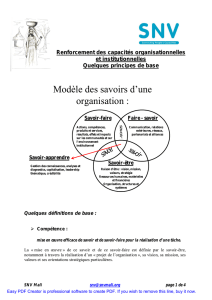
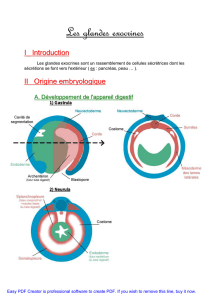
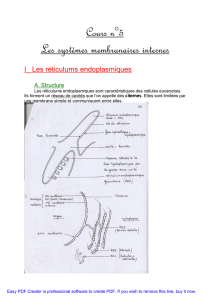
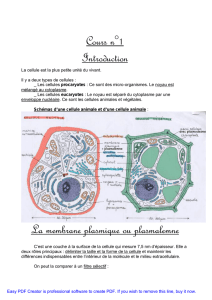
Chimie et alimentation - Pages Persos Chez.com

C
C
Ch
h
hi
iim
m
mi
iie
e
ee
e
et
tta
a
al
lli
iim
m
me
e
en
n
nt
tta
a
at
tti
iio
o
on
n
n
I
I_
_A
Ar
rô
ôm
me
es
s
A
A.
.P
Pe
er
rc
ce
ep
pt
ti
io
on
ne
et
ts
st
tr
ru
uc
ct
tu
ur
re
ed
de
es
sm
mo
ol
lé
éc
cu
ul
le
es
s
Un arôme est l'ensemble des composés odorants volatiles issus d'un aliment.
Presque toutes les classes de molécules peuvent donner un arôme ( sauf les thiols
et les halogénés ). Même s'ils n'ont aucune valeur nutritive, leur rôle dans
l'alimentation est important, en effet ils donnent l'envie ( ou le dégoût ) de manger.
Ils sont présents en très faible quantité dans les aliments. Ce sont souvent des
mélanges complexes ( ex : l'arôme de tomate est formé de 300 molécules !!! ) même
si certains composés ont une odeur propre.
Les arômes et les parfums interagissent avec les mêmes récepteurs
cellulaires, mais pas toujours par les mêmes mécanismes. On dit qu'il y a une
flaveur, c'est-à-dire une association entre le goût et l'odorat.
La stéréochimie de l'arôme peut avoir une influence. Leur structure contient
souvent des hétérocycles.
On sépare les arômes en trois groupes :
q
qNaturels, à partir de matières premières végétales ou animales, utilisées telles
quelles et obtenues par des procédés enzymatiques, bactériologiques ou
physiques.
q
qSynthétiques,identiques aux composés naturels mais synthétisés par voie
chimique.
q
qArtificiels, ces arômes n'existent pas dans la nature.
B
B.
.F
Fo
or
rm
ma
at
ti
io
on
nd
de
es
sa
ar
rô
ôm
me
es
sd
da
an
ns
sl
le
es
sa
al
li
im
me
en
nt
ts
s
Un arôme s'obtient parfois par la transformation de l'aliment. Les précurseurs
de ces arômes sont souvent les principaux constituants des aliments, c'est-à-dire les
acides aminés, les sucres, les lipides et les vitamines.
L'arôme peut provenir d'une réaction enzymatique, comme par exemple une
fermentation bactérienne, ou par un réaction de brunissement ( ou de Maillard ) en
chauffant l'aliment.
Ex : principale réaction des acides aminés formant des arômes
C
C.
.S
Sy
yn
nt
th
hè
ès
se
ec
ch
hi
im
mi
iq
qu
ue
ed
d'
'a
ar
rô
ôm
me
es
s
1
1)
)A
Ar
rô
ôm
me
es
sd
du
ug
gr
ro
ou
up
pe
e2
2(
(s
sy
yn
nt
th
hé
ét
ti
iq
qu
ue
es
s)
)
l
lV
Va
an
ni
il
ll
li
in
ne
e:
:
àMolécule
HOO NH2
R
Ç
O
CH
R
Easy PDF Creator is professional software to create PDF. If you wish to remove this line, buy it now.

àRéaction
l
l
l
lA
An
né
ét
th
ho
ol
l:
:
àMolécule
àRéaction
l
lC
Ci
in
nn
na
am
ma
al
ld
dé
éh
hy
yd
de
e:
:
àMolécule
àOdeur et arôme de vanille
O
OH
OH
Gaïacol
( produit naturel )
O
OH
H
H+
O O
OHH
+
H+
SEAr
O
OH
OH
HO
O
O2(air)
Catalyseur
Oxydation
O
OH
O
O
O
H
Décarboxylation Ç,H+
O
OH
OH
+CO2
àArôme d'anis
O
O
HSEAr
O
Cl O
O
H2/cat
O
HO
H+
H
H+,Ç
Déshydratation
O
+H2O
àArôme d'anis
O
H
Easy PDF Creator is professional software to create PDF. If you wish to remove this line, buy it now.

àRéaction
2
2)
)A
Ar
rô
ôm
me
ed
du
ug
gr
ro
ou
up
pe
e3
3(
(a
ar
rt
ti
if
fi
ic
ci
ie
el
ls
s)
)
l
lÉ
Ét
th
hy
yl
lv
va
an
ni
il
ll
li
in
ne
e:
:
àMolécule
l
lF
Fl
la
av
ve
eu
ur
rd
de
ep
po
op
p-
-c
co
or
rn
n:
:
àRéaction
I
II
I_
_L
Le
es
sm
mo
ol
lé
éc
cu
ul
le
es
sd
du
ug
go
oû
ût
t
Le goût est quelque fois lié à l'odorat, mais la perception des différents goûts
qui sont sucré,amer,acide et salé dépendent de récepteurs situés sur la langue.
1
1)
)G
Go
oû
ût
ts
su
uc
cr
ré
é
Presque tous les humains aiment le goût sucré. En fait son absorption
déclencherait la sécrétion d'endorphines ( molécule de plaisir ).
D'ailleurs les commerçants l'ont bien compris puisque l'on retrouve du sucre dans presque
tous les aliments.
O
H+
H
àOdeur d'amande amère
H+( ou OH-)
OH HO
H
H
OH+,Ç
H
O
H+
H
+H2O
Déshydratation
àArôme de vanille 3 fois plus puissant
que la vanilline naturelle
àMême synthèse que la vanilline
O
OH
OH
O O
+H2NH+
O
NCopie le goût de
O
N
àGoût de grillé, eau,
pop-corn
Easy PDF Creator is professional software to create PDF. If you wish to remove this line, buy it now.

Les molécules sucrées ont une multitude de formes différentes : les glucides
en forment la majeure partie, certains composés cycliques ou aromatiques, certains
peptides et quelques sels minéraux.
2
2)
)G
Go
oû
ût
ts
sa
al
lé
é
Ce goût est lié aux petits cations alcalins, tels que Na+ou Li+. On utilise
communément NaCl ( sel de cuisine ). Ces molécules ont souvent des propriétés
antibiotiques.
3
3)
)G
Go
oû
ût
ta
ac
ci
id
de
e
Ce goût est donné par des acides aqueux ( qui produisent H3O+ ) ou
organiques ( on utilise communément l'acide citrique, maléique ou tartrique ).
4
4)
)G
Go
oû
ût
ta
am
me
er
r
Ce goût est déclenché par des sels inorganiques avec des gros cations (K+,
Na+, Ca2+,NH4+…), ou des alcaloïdes (la caféine, la théobromine ou la théophylline).
CH2OH
OH H
OHOH
OH
OH H
H
Glucose
H3N
O
O
O
NH
O
O
Aspartame
Aspartyl-Phenylalanine-méthylester
OH
O
O
OOH
OH
HO
Acide citrique
N
N
N
N
O
O
H
CH3
CH3
N
N
N
N
O
O
H
CH3
N
N
N
N
O
O
H
CH3
Caféine
Provient du café Théophylline
Provient du thé Théobromine
Provient du cacao
Easy PDF Creator is professional software to create PDF. If you wish to remove this line, buy it now.

I
II
II
I_
_L
Le
es
sc
co
on
ns
st
ti
it
tu
ua
an
nt
ts
sd
de
es
sa
al
li
im
me
en
nt
ts
s
On distingue deux groupes : les nutriments constitués des lipides, des
glucides et des protéines ; et les micro-nutriments soit certains minéraux ( Ca2+,K+,
P,Mg2+ … ) et les vitamines. Ces derniers sont requis en plus petite quantité, mais
restent vitaux.
I
IV
V_
_L
Le
es
sa
ad
dd
di
it
ti
if
fs
sa
al
li
im
me
en
nt
ta
ai
ir
re
es
s
On appelle additif alimentaire une substance introduite dans un produit
alimentaire, dans un but technologique ou organoleptique. Un additif peut, par
exemple, augmenter la durée de conservation de l'aliment, améliorer son assimilation
( épaississant ou gélifiant ) ou changer son apparence ( colorants ).
Un additif est identifié par la lettre E, suivie de trois chiffres.
A
A.
.C
Co
ol
lo
or
ra
an
nt
ts
sa
al
li
im
me
en
nt
ta
ai
ir
re
es
s
Avant 1850, les colorants provenaient de végétaux comestibles ou d'animaux
et végétaux non-consommés. Beaucoup sont toujours utilisés, mais une bonne partie
a été remplacée par des colorants synthétiques.
Ex : La couleur orange s'obtenait à partir de carottes, le rouge provenait de la betterave.
Depuis 1960, des lois limitent le nombre de colorants utilisés dans l'agro-
alimentaires pour limiter les risques et mieux connaître leurs effets. On peut ainsi
utiliser 7 colorants naturels et 11 colorants synthétiques sont admis.
Les colorants synthétiques ont des avantages comparés aux colorants
naturels :
q
qLes colorants naturels se conservent mal ; ils sont souvent sensibles à la
lumière ou à certaines bactéries.
q
qLes colorants synthétiques sont souvent plus stables et donnent une
coloration plus intense ; on en utilise donc une plus faible quantité.
q
qIls sont moins coûteux à produire en termes de temps, d'argent et de
masse biologique exploitée.
Le colorant a pour seul but de … Colorer l'aliment. Incroyable non ?! Certains
colorants peuvent être transformés en vitamine ( notamment le Ò-carotène en
vitamine A ou la tartrazine qui stabilise la vitamine C ). On peut aussi les utiliser pour
protéger l'aliment du Soleil.
Les colorants sont souvent des molécules azoïques.
On les nomme : R—N N—R'
E1XY
Colorant Couleur
Ex : 2 = rouge
Numéro du
colorant
Easy PDF Creator is professional software to create PDF. If you wish to remove this line, buy it now.
 6
6
 7
7
 8
8
 9
9
1
/
9
100%