Les acides carboxyliques et dérivés

L
L
Le
e
es
s
sa
a
ac
c
ci
iid
d
de
e
es
s
sc
c
ca
a
ar
r
rb
b
bo
o
ox
x
xy
y
yl
lli
iiq
q
qu
u
ue
e
es
s
se
e
et
ttd
d
dé
é
ér
r
ri
iiv
v
vé
é
és
s
s
I
I_
_G
Gé
én
né
ér
ra
al
li
it
té
és
s
Cette fonction est très répandue dans les molécules biologiques et très utilisée
dans l'industrie. C'est une fonction terminale, c'est-à-dire qu'elle termine une chaîne
de carbone aliphatique.
A
A.
.G
Gr
ro
ou
up
pe
em
me
en
nt
tc
ca
ar
rb
bo
ox
xy
yl
le
e
B
B.
.N
No
om
me
en
nc
cl
la
at
tu
ur
re
e
àChaîne aliphatique : Acide alcanoïque
àChaîne aromatique : Acide cycloalcancarboxylique
jLes acides carboxyliques ont souvent des noms triviaux
Nom officiel Nom trivial
Acide méthanoïque Acide formique (fourmi)
Acide éthanoïque Acide acétique
Acide propanoïque Acide propionique
Acide butanoïque Acide butyrique (beurre)
Acide cyclohex-1,3,5-triencarboxylique Acide benzoïque
Acide éthandioïque Acide oxalique
Remarque : Les acides carboxyliques qui ont plus de 10 atomes de carbones
constituent les acides gras.
C
C.
.P
Pr
ro
op
pr
ri
ié
ét
té
és
sp
ph
hy
ys
si
iq
qu
ue
es
s
Les acides carboxyliques peuvent former beaucoup de liaisons hydrogènes.
Ceci leur confère une bonne stabilité, il faut donc fournir beaucoup d'énergie pour les
dissocier. Ainsi la température d'ébullition des acides carboxyliques est plus élevée
que celle des alcools et des alcanes.
Plus leur chaîne est longue, moins les acides sont faciles à dissocier. Ainsi,
plus la chaîne est grande, plus leur température d'ébullition est élevée.
D
D.
.S
So
ol
lu
ub
bi
il
li
it
té
é
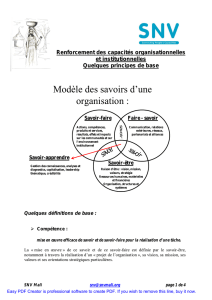
RC
O
OH
Groupement
plan
Très acide
Délocalisation
Base de
Lewis
Easy PDF Creator is professional software to create PDF. If you wish to remove this line, buy it now.

Plus la chaîne carbonée est longue, moins l'acide est soluble dans l'eau. Un
carboxylate est quant à lui, toujours soluble dans l'eau. Ainsi :
àDe 1 à 4 carbones, l'acide est soluble en toutes proportions
àLes aromatiques sont toujours insolubles
I
II
I_
_P
Pr
ré
ép
pa
ar
ra
at
ti
io
on
nd
de
es
sa
ac
ci
id
de
es
s
A
A.
.O
Ox
xy
yd
da
at
ti
io
on
nd
de
es
sa
al
lc
cè
èn
ne
es
s
àOn peut utiliser les mêmes réactions sur les alcynes
l
lO
Oz
zo
on
no
ol
ly
ys
se
e:
:
Remarque : s'il y a formation d'acide formique, celui-ci ne reste pas stable est
devient du dioxyde de carbone
l
lO
On
np
pe
eu
ut
ta
au
us
ss
si
iu
ut
ti
il
li
is
se
er
rK
KM
Mn
nO
O4
4c
co
on
nc
ce
en
nt
tr
ré
éà
àc
ch
ha
au
ud
d
B
B.
.O
Ox
xy
yd
da
at
ti
io
on
nd
de
es
sa
al
lc
co
oo
ol
ls
s
àSeuls les alcools primaires donneront des acides carboxyliques
Réactif de Sarret : CrO3+ 2 pyridines
Réactif de Jones : CrO3+H2SO4
C
C.
.O
Ox
xy
yd
da
at
ti
io
on
nd
de
es
sa
al
lk
ky
yl
lb
be
en
nz
zè
èn
ne
es
s
àOn forme de l'acide benzoïque
Remarque : la réaction est très difficile avec les alkyles tertiaires
àOn peut aussi utiliser K2Cr2O7à pH acide.
D
D.
.O
Ox
xy
yd
da
at
ti
io
on
nd
de
es
sm
mé
ét
th
hy
yl
lc
cé
ét
to
on
ne
es
s
H
Au moins un atome
d'hydrogène
O3
H2O
Sans milieu réducteur
O+OOH
R—CH2—OHRéactif de Sarret R—CO—HAg2OR—COOH
Réactif de Jones
CH2RKMnO4
NaOH,ÇCOOH
H
HO3
H2OO+OOH
HCO2
Easy PDF Creator is professional software to create PDF. If you wish to remove this line, buy it now.

l
lR
Ré
éa
ac
ct
ti
io
on
na
au
ux
xh
ha
al
lo
of
fo
or
rm
me
es
s:
:
E
E.
.O
Or
rg
ga
an
no
om
ma
ag
gn
né
és
si
ie
en
ns
s
F
F.
.H
Hy
yd
dr
ro
ol
ly
ys
se
ed
de
es
sd
dé
ér
ri
iv
vé
és
sd
d'
'a
ac
ci
id
de
es
s
1
1)
)C
Ch
hl
lo
or
ru
ur
re
ed
d'
'a
ac
ci
id
de
e
àHydrolyse :
Remarque : une hydrolyse n'est pas une SN1, c'est une addition suivie d'une
élimination.
2
2)
)E
Es
st
te
er
r
àHydrolyse :
RCH2
O
OH
H
CH2
O
R
Équilibre céto-
énolique dans
une base
Additions
électrophiles
faciles
Br2
3 fois CBr3
O
RBon groupe
partant H2O
O
RO+HCBr3
Haloforme
R—XMg0R—Mg—XCO2R—COO Mg—XH+/H2OR—COOH
RCl
O
àFort effet inductif de la part du chlore,
substitutions nucléophiles très faciles sur
le C==O.
ROR'
O
Nucléophile
faible
H
Plus réactif lorsqu'il est
catalysé par un acide et
sous chauffage
+H2O
H+,Ç
Réversible
Pour déplacer l'équilibre, on
fait la réaction en excès d'eau.
ROH
O
+R'—OH
RCl
O+H2ORHCl
O
OH
+
Réaction très
facile et totale
R C
O
OR'
H
H H
O
R C
OH
OR'
H H
O
Prototropie
R C
OH
OR'
H
OH
Bon groupe
partant
R C
O
OR'
H
+R'OH
Easy PDF Creator is professional software to create PDF. If you wish to remove this line, buy it now.

Remarque : Un R encombré défavorise cette réaction.
àSaponification :
3
3)
)A
An
nh
hy
yd
dr
ri
id
de
ed
d'
'a
ac
ci
id
de
e
4
4)
)A
Am
mi
id
de
es
s
àMilieu acide :
àMilieu basique :
5
5)
)N
Ni
it
tr
ri
il
le
es
s
Remarque : Cette réaction est très intéressante car on obtient facilement un nitrile à
partir d'un dérivé halogéné.
R C
O
OR' Na OH
H2O,ÇR C
O
OR'
OH
R C
O
OR'
OH
+RCOO +R'OH
Difficile à attaquer de manière
nucléophile ( effets
mésomères stabilisants )
H3O+
RCOOH
O O
O
Très électroattracteur
H2ORCOOH+R'COOH
Réaction très
facile
R C
O
NR' H
H2O,Ç
R''
Caractère nucléophile
gêné par l'azote
Réaction difficile
Besoin d'un acide fort et de
chauffage
R C
O
NR'
R''
OH H
+
R C
O
NR' Na OH
H2O,Ç
R''
Un petit peu
plus facile
R C
O
NR'
R''
OH
+
RCN
H3O+,Ç
OH-/H2O,Ç
RCOOH
RCOO- +Na
Très acide et
à reflux
RCNÇ
H
OHH
CNH
OHH
R C NH
O
H
R
H
CNH2
O
R
Amide
Easy PDF Creator is professional software to create PDF. If you wish to remove this line, buy it now.

I
IV
V_
_R
Ré
éa
ac
ct
ti
iv
vi
it
té
é
A
A.
.P
Pa
ar
rt
ti
ic
cu
ul
la
ar
ri
it
té
és
sC
Ch
hi
im
mi
iq
qu
ue
es
s
B
B.
.R
Ré
éa
ac
ct
ti
io
on
ns
sd
du
ue
es
sa
au
uc
ca
ar
ra
ac
ct
tè
èr
re
ea
ac
ci
id
de
e
1
1)
)A
Av
ve
ec
cl
le
es
so
or
rg
ga
an
no
om
ma
ag
gn
né
és
si
ie
en
ns
s
La réaction doit se faire dans un solvant anhydre afin d'empêcher la réaction
violente du magnésium avec l'eau, et polaire qui a un effet stabilisant sur les
magnésiens.
On n'observe qu'une réaction acido-basique.
2
2)
)A
Av
ve
ec
cl
le
ed
di
ia
az
zo
om
mé
ét
th
ha
an
ne
e
Ex :
Remarque : C'est une réaction très rapide et très facile ( explosive si non contrôlée ),
mais le diazométhane est hautement cancérigène.
RC
O
OH
Très acide
Base de
Lewis
C
HH
Caractère
électrophile
Acide
Acide carboxylique
R C O
O
Cette molécule a une
équivalence infinie ( même
forme mésomère ).
Carboxylate
Beaucoup plus
nucléophile
Caractère électrophile
très diminué
R—COOH+ R'—Mg—X àR—COO- +Mg—X + R'H
CH2N N
Excellent
groupe partant
Nucléophile et
basique
Diazométhane
O
H
O+CH2N N Et2OO
O+CH3N N
O
O
CH3+N2
Easy PDF Creator is professional software to create PDF. If you wish to remove this line, buy it now.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
1
/
13
100%