iii-1 : la retine : organisation schematique - Lodel

Œil et Physiologie de la Vision – III-1
III-1 : LA RETINE : ORGANISATION SCHEMATIQUE
Florence Rigaudière
Pour citer ce document
Florence Rigaudière, «III-1 : LA RETINE : ORGANISATION SCHEMATIQUE», Oeil et
physiologie de la vision [En ligne], III-La physiologie rétinienne, mis à jour le
18/06/2013, URL :
http://lodel.irevues.inist.fr/oeiletphysiologiedelavision/index.php?id=212,
doi:10.4267/oeiletphysiologiedelavision.212
Plan
I - Neurorétine
Trois étages
Premier étage : les cônes et les bâtonnets
Les cônes
Les bâtonnets
Relation avec l’épithélium pigmentaire
Couche plexiforme externe : les cellules horizontales
Cellules HI
Cellules HII
Cellules HIII
Jonctions gap entre cellules horizontales
Deuxième étage rétinien : les cellules bipolaires
Généralités
Cellules bipolaires de cônes L ou M, naines
Cellules bipolaires de cônes L et M, diffuses
Deux maillages pour les cônes L et/ou M
Cellules bipolaires de cônes S
Cellules bipolaires de bâtonnets
Cellules interplexiformes
Couche plexiforme interne : les cellules amacrines
Des cellules spécifiques
Parmi vingt variétés, une essentielle : la cellule amacrine AII
Troisième étage : les cellules ganglionnaires
Nombre et densité
Particularités
Cellules ganglionnaires naines
Cellules ganglionnaires parasols
Cellules ganglionnaires bistratifiées
Autres cellules ganglionnaires à destination extragéniculée
Trois voies rétinocorticales : organisation et destinée
Voie P
Voie M
Voie K
Séparation des trois voies jusqu’au cortex
Tests des voies P et K
1

Œil et Physiologie de la Vision – III-1
Deux systèmes rétiniens: photopique et scotopique
Système photopique
Système scotopique
Explorations différentielles du système photopique et scotopique
Les cellules de Müller
II - L’épithélium pigmentaire
Description
Vascularisation
III - Application à la lecture des images rétiniennes en OCT
Conclusion
Texte intégral
Remerciements à C. Curcio pour ses illustrations.
La rétine est une structure complexe organisée en deux parties : la neurorétine et
l’épithélium pigmentaire.
La neurorétine est essentiellement « photosensible ». Elle est capable de convertir les
photons lumineux en influx visuels transmis jusqu’aux différentes aires visuelles pour
aboutir à la vision. Elle peut être explorée tant en surface, que selon ses strates par des
tests fonctionnels d’électrophysiologie visuelle.
Une partie de la neurorétine dont l’importance fonctionnelle se révèle grandissante, est
« luminosensible ». Elle réagit à la lumière et à ses caractéristiques, ne permet pas de
voir, mais de réguler l’humeur et le cycle nycthéméral. Il en sera dit un mot, bien que
cette neurorétine ne soit pas actuellement explorable par des tests visuels cliniques.
En complément des explorations fonctionnelles rétiniennes par électrophysiologie,
l’imagerie anatomique rétinienne par OCT (Optical Coherence Tomography) est de
pratique courante.
Mettre en parallèle les images obtenues par OCT et les différentes structures
rétiniennes -récepteurs, couches nucléaires, épithélium pigmentaire- permettront d’en
mieux situer les anomalies.
I - Neurorétine
Seule l’architecture des principaux éléments utiles à la compréhension de l’exploration
visuelle clinique est présentée ici ; ses aspects fonctionnels sont développés dans la
partie suivante III-2, ses caractéristiques macroscopiques et vasculaires sont décrites au
chapitre IV.
La structure de la neurotéine peut être regroupée selon trois étages, trois voies (P, M, et
K) et deux systèmes photopique et scotopique. L’exposé ci-dessous des grands piliers de
son architecture résume les travaux effectués chez l’homme et les grands primates dont
le système visuel est proche de celui de l’humain [Kolb H, 2006], [Kolb H et al.].
2

Œil et Physiologie de la Vision – III-1
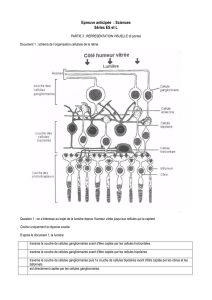
Trois étages
D’un point de vue fonctionnel, la neurorétine peut être stratifiée en trois étages (figure
III-1-1), sauf au niveau de la fovéola correspondant à un seul étage, constitué
essentiellement par les articles externes de cônes (figure III-1-2).
Remarque importante. Figure III-1-3. Convention d’orientation dans la description de la neurorétine. Elle
correspond au sens de propagation du signal électrophysiologique qui est initié par les photorécepteurs ou 1er
étage. La propagation se poursuit schématiquement vers les cellules bipolaires ou 2ième étage ; la sous couche-a
de la couche plexiforme interne est rencontrée la première, elle est dite sous couche-a superficielle, la sous
couche-b vient ensuite, elle est dite sous couche-b profonde. Le signal atteint enfin les cellules ganglionnaires
ou 3ième étage ; la propagation se poursuit le long des nerfs optiques…
Les photorécepteurs forment le premier étage rétinien ou étage réceptoral. Ils font
synapse à la couche plexiforme externe avec des cellules d’association, les
horizontales et leurs cellules bipolaires qui constituent le deuxième étage rétinien jusqu’à
la couche plexiforme interne. Cette dernière est essentiellement divisée en deux sous
couches, la sous couche-a, superficielle et la sous couche-b, plus profonde. Le troisième
étage correspond aux cellules ganglionnaires qui font synapse à la couche plexiforme
interne avec les cellules bipolaires sus-jacentes et des cellules d’association, les
amacrines (figure III-1-1).
Les axones des cellules ganglionnaires se myélinisent à partir de la lame criblée de la
papille, pour former les fibres des nerfs optiques.
Premier étage : les cônes et les bâtonnets
Les cônes
Les cônes sont répartis sur toute la rétine et cohabitent avec les bâtonnets sauf au
niveau de la fovéola où ils sont seuls (figure III-1-2, figure III-1-4)
Nombre
Le comptage des cônes chez l’homme s’est effectué sur des prélèvements de fragments
de tissu rétinien [Curcio CA et al., 1990] ou grâce à des méthodes de visualisation des
photorécepteurs in vivo [Miller DT et al., 1996], [Delint PJ et al., 1997], [Marcos S et al.,
1997], [Roorda A, 2000].
Chez l’adulte, les cônes sont en moyenne 4,6 millions (de 4 à 5,3 millions selon les
sujets analysés), soit 20 fois moins environ que le nombre des bâtonnets (92 millions)
[Curcio CA et al., 1990]. Ils sont répartis sur toute la rétine, de façon plus régulière en
rétine temporale qu’en rétine nasale et ce, à tous les âges et pour les deux sexes
[Kimble TD, Williams RW, 2000].
En dehors de la fovéola…
…des bâtonnets s’intercalent régulièrement en mosaïque, entre les cônes. Les 10 degrés
centraux contiennent 500 000 cônes environ, soit moins de 10% du total. Au-delà de six
degrés d'excentricité, un cône peut être complètement entouré de bâtonnets voire
jusqu'à 48 bâtonnets (figure III-1-5).
La fovéola
C’est une exception rétinienne avec un seul étage rétinien. Sur cette surface très
restreinte (< 0,1mm2), il n’y a que 10 000 cônes environ [Wassle H et al., 1989].
3

Œil et Physiologie de la Vision – III-1
Elle abrite essentiellement les articles externes des cônes et 300 à 500 noyaux de leurs
articles internes [Ahnelt PK, 1998]. La majeure partie des noyaux des cônes fovéolaires
sont déjetés en dehors de la dépression fovéale ; ils forment ses berges ou clivus fovéal.
Les synapses de ces cônes avec les cellules sous-jacentes se font en dehors de la
fovéola.
Densité
La densité des cônes est maximale à la fovéola. Elle varie entre 300 000/mm2 et
80 000/mm² selon les sujets ; c’est la plus importante de toute la rétine (figure III-1-6).
Elle décline très rapidement en dehors des quelques degrés centraux pour atteindre une
valeur d’environ 5000/mm² à quelques degrés d’excentricité.
Article externe
Morphologie
Pour une même région rétinienne et d'un point de vue histologique, les articles externes
de cônes adjacents sont semblables et de forme conique (figure III-1-7, figure III-1-8)
d'où leur nom. Ils ne peuvent être différenciés que par l’utilisation de coloration
spécifique (figure III-1-9) [McCrane EP et al., 1983], [Curcio CA et al., 1991].
L’article externe est constitué d’une seule membrane qui sépare le milieu extracellulaire
du milieu intracellulaire. Une partie de cette membrane présente des plis sur lesquels se
trouvent inclus les photopigments des cônes qui sont ainsi en relation directe avec le
milieu extracellulaire (figure III-1-7).
Le diamètre de l'article externe des cônes varie selon les individus (figure III-1-10) et en
fonction de l’excentricité, de 1,5 µm environ à la fovéola [Curcio CA, Hendrickson AE,
1991] à 6 µm environ à la périphérie. Son diamètre est deux à trois fois supérieur à celui
des bâtonnets et ce, pour toutes les excentricités rétiniennes (figure III-1-5).
La longueur des cônes varie entre 80 µm en zone fovéolaire et 22 µm à la périphérie
[Willmer EN, 1987]. En un lieu donné, elle est constante grâce à un équilibre entre la
phagocytose de son extrémité distale par l’épithélium pigmentaire et sa croissance qui se
situe au niveau du cil connecteur à l’article interne (figure III-1-8) [Anderson DH et al.,
1978], [Steinberg RH et al., 1980] [Boesze-Battaglia K, Goldberg AF, 2002], [Kevany
BM, Palczewski K, 2010].
Trois photopigments différents pour trois types de cônes L, M, S
Les photopigments portés par la membrane des articles externes sont de compositions
différentes, à l’origine des propriétés caractéristiques de trois types de cônes dits L, M ou
S selon leur probabilité d’absorption des photons, en fonction de la longueur d’onde de la
stimulation.
Les cônes L présentent une probabilité maximale d’absorption des photons pour les
grandes longueurs d’onde (Long wavelengths) située vers 560 nm, les cônes M, une
probabilité maximale d’absorption des photons pour les moyennes longueurs d’onde
(Middle wavelengths) située vers 530 nm et les cônes S, une probabilité maximale
d’absorption des photons pour les courtes longueurs d’onde (Short wavelengths) située
vers 420 nm (figure II-17).
Ces trois types de cônes se répartissent en deux groupes, les cônes L et M d’une part et
les cônes S d’autre part. Ils sont de nombre, de répartition et d’origines différentes.
Cônes L et M
Les cônes L et M sont les plus nombreux environ 90 % des 4 à 5,3 millions de cônes ; ils
sont présents sur toute la rétine [Curcio CA et al., 1990], [Schiller PH, 1996].
4

Œil et Physiologie de la Vision – III-1
Leurs photopigments L et M sont codés par des gènes différents, situés à proximité l’un
de l’autre sur le chromosome X [Sharpe LT et al., 1999].
La composition anormale ou la déficience de l’un ou l’autre des photopigments ou des deux, sont à l’origine de
dyschromatopsies héréditaires liées à l’X [Rigaudiere F et al., 2006].
La proportion relative des cônes L et M chez l’homme est très variable d’un individu à
l’autre. Elle peut osciller de 70% de cônes L avec 20% de cônes M [Cicerone CM, Nerger
JL, 1989], [Kremers J et al., 1999], [Lennie P, 2000] à des valeurs plus extrêmes allant
de 83% à 36% de cônes L, pour 7% à 54% de cônes M [Carroll J et al., 2000].
Les cônes L sont sensiblement deux fois plus nombreux que les cônes M dans la fovéola
[Cicerone CM, Nerger JL, 1989], en parafovéa (c’est-à-dire jusqu’à quatre degrés
d’excentricité [Nerger JL, Cicerone CM, 1992]) et probablement aussi pour des
excentricités supérieures [Otake S et al., 2000]. Mais ils se répartissent au hasard l’un
par rapport à l’autre [Roorda A, Williams DR, 1999], [Roorda A et al., 2001] plutôt que
de façon homogène et isotrope [Gowdy PD, Cicerone CM, 1998] (figure II-16).
Cônes S
Les cônes S correspondent à 10 % environ de tous les cônes [Ahnelt PK et al., 1987]. Le
photopigment S porté par leur article externe est codé par le chromosome 7 [Fitzgibbon J
et al., 1994].
Ils sont absents du cœur de la fovéola sur un diamètre d’environ 100 µm ou surface vue
sous un angle de 20’ environ (0,35°) [Bumsted K, Hendrickson A, 1999], [Curcio CA et
al., 1991] (figure III-1-11). Les cônes L et M y sont seuls présents, à l’origine d’un
phénomène connu de longue date : la tritanopie fovéale [Williams DR et al., 1981].
La vision des couleurs normale se fait à l’aide de la synthèse des signaux issus des trois photopigments
décrits : L (ou premier pigment), M (ou deuxième pigment) et S (ou troisième pigment). La tritanopie
correspond à an-opie (en grec) : absence de vision, du troisième pigment : tri.
Ceci signifie que sur cette surface très restreinte, la vision des couleurs est dichromate, ne se faisant que grâce
à la synthèse des signaux issus de deux types de cônes présents L et M.
En dehors de cette zone, un cône S peut être entouré par 5, 6 ou 7 cônes L et M [Ahnelt
PK et al., 1987], ils se répartissent de façon régulière sur toute la rétine [Calkins DJ,
2001], sous forme d’une mosaïque de géométrie intermédiaire entre un triangle, un
carré [De Monasterio FM et al., 1985], [Curcio CA, Hendrickson AE, 1991] ou un
hexagone (figure III-1-12).
Les cônes S n’ont pas la même densité sur toute la rétine. La majorité des cônes S se
trouvent dans les 12 degrés centraux avec une densité maximale allant de 1000 à
5000/mm2 sur un anneau situé entre 0,75 et 1,5° d’excentricité (berge fovéale) [Ahnelt
PK, 1998], la densité des cônes S étant de l’ordre de 1000/mm2 sur le reste de la rétine
[Curcio CA et al., 1991], [De Monasterio FM et al., 1985] (figure III-1-13).
Jonction article externe-article interne, article interne
L’article externe est connecté à l’article interne par un cil (figure III-1-8), zone de
croissance régulière de l’article externe [Roepman R, Wolfrum U, 2007], [Trojan P et al.,
2008]. Cette croissance se fait par évagination de la membrane au niveau du cil
connecteur article externe-article interne, avec des modalités différentes pour les cônes
et les bâtonnets [Eckmiller M, 1997].
L’article interne contient le noyau et tous les organites nécessaires au fonctionnement
métabolique du cône.
5
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
1
/
49
100%