Transformation forcée: l`électrolyse - Physique

Transformation forcée: l'électrolyse
I. Etude d'un cas.
1. Réaction spontanée entre le cuivre (métal) et le dibrome en solution aqueuse.
Dans un tube à essais, on met en présence de la tournure de cuivre (Cu) et du dibrome (Br2) en solution aqueuse
([Br2]i=1,0.10-2 mol.L-1). La solution initialement jaune (couleur du dibrome en solution aqueuse) se colore
progressivement en bleu (couleur d'une solution aqueuse d'ions Cu2+) et le cuivre métallique disparaît.
L'équation de cette réaction est: Cu + Br2 = Cu2+ + 2Br - avec: K = 1,2.1025
Cette évolution est spontanée dans le sens direct de l'équation, ce qui est en
accord avec le critère d'évolution
KQrQrQr
Br BrCu
Qr iii
i
ii
i
0
10.0,1 02
2
2
2
K >> 104 la réaction est quasi totale dans le sens direct de l'équation. Le
taux d'avancement final est très proche de 1 (100%).
2. Transformation forcée.
a. Expérience.
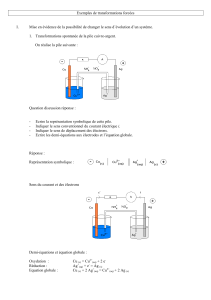
On réalise l'expérience schématisée ci-dessous.
Le symbole du générateur barré d'une flèche représente un générateur dont on peut faire varier progressivement
la tension entre ses bornes.
Lorsque la tension appliquée est trop faible (<1,2V) il ne se passe rien, c’est la tension de seuil. Pour une
tension appliquée supérieure à cette tension de seuil (1,2V), on observe un dépôt de cuivre sur l'électrode
négative (cathode) et l'apparition de dibrome en solution au voisinage de l'électrode positive (anode).
b. Interprétation.
-A la cathode:
Cu2+ + 2e- = Cu
gain d'électrons, c'est une réduction
-A l'anode:
2Br - = Br2 + 2e-
perte d'électrons c'est une oxydation
-Bilan
Cu2+ + 2Br - = Cu + Br2
Ce bilan est l'inverse de celui correspondant à l'évolution spontanée.
c. Conclusion.
Dans certaines conditions (notamment de tension), lorsqu'un générateur fournit de l'énergie électrique à
un système, il peut le forcer à évoluer dans le sens contraire du sens d'évolution spontanée.
4. Généralisation.
Lorsqu'un générateur de tension continue impose
dans un système chimique un courant de sens
inverse à celui qui est observé lorsque le système
évolue spontanément (pile), il peut imposer à ce
système d'évoluer dans le sens inverse de son sens
d'évolution spontanée.
Cette transformation forcée est appelée
électrolyse.
L'électrode à laquelle se produit une oxydation est appelée anode (électrode par laquelle le courant entre
(arrive) dans l'électrolyseur).
L'électrode à laquelle se produit une réduction est appelée cathode (électrode par laquelle le courant sort
de l'électrolyseur).

II. Électrolyse d'une solution de chlorure de sodium.
1. Remarque
Les réactions qui peuvent se produire aux électrodes lors d'une électrolyse sont en général nombreuses. Toutes
les espèces chimiques en solution, le solvant et les électrodes susceptibles de donner lieu à une oxydation ou à
une réduction peuvent à priori participer aux transformations chimiques.
A notre niveau, on demande simplement d'être en mesure d'identifier les corps qui apparaissent lors d'une
électrolyse, d'en déduire les demi-équations rédox des réactions qui se produisent aux électrodes et d'écrire
le bilan électrochimique et le bilan de matière.
2. Électrolyse d'une solution de chlorure de
sodium.
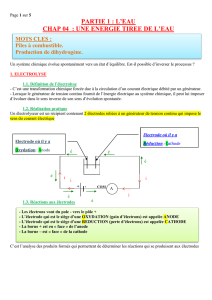
a. Montage et observations.
Le sens du passage du courant est connu. Le montage
et les observations sont donnés ci-contre.
b. Interprétation.
Inventaire des espèces chimiques présentes et
pouvant intervenir:
Le solvant (H2O), les ions sodium (Na+) et les ions
chlorure (Cl-) (le carbone (C) des électrodes ne jouent
pas de rôle ici, les électrodes sont dites inertes).
Espèce pouvant donner lieu à une oxydation à l'anode: Les ions chlorure, réducteur du couple Cl2 / Cl- et l'eau,
réducteur du couple O2 / H2O.
Espèces pouvant donner lieu à une réduction à la cathode: Les ions sodium, oxydant du couple Na+ / Na et
l'eau, oxydant du couple H2O / H2.
Ce qui se passe réellement.
-La décoloration de l'indigo au voisinage de l'anode indique qu'il y a apparition
de dichlore:
2Cl- = Cl2 + 2e-
-La coloration de la phénolphtaléine au voisinage de la cathode indique qu'il y a
apparition d'ions hydroxyde HO-.
L'identification du dihydrogène dans le tube à essais se fait grâce à l'aboiement
en présence d'une flamme.
2H2O + 2e- = H2 + 2HO-
_____________________________
-Bilan:
2H2O + 2Cl- = Cl2 + H2 + 2HO-
c. Résumé.
Connaissant le sens du courant, il est possible d'envisager les différentes oxydations possibles à l'anode et les
différentes réductions possibles à la cathode en sachant que le solvant et les électrodes peuvent éventuellement
participer aux réactions. C'est l'analyse des produits formés qui permet de déterminer les réactions qui se
produisent réellement aux électrodes.
III-Electrolyse de l’eau (d'une solution d'acide sulfurique) :
Les espèces présentent sont : l'eau H2O, les ions sulfate SO42-, les ions H+.
Les couples susceptibles d'être mis en jeu sont :
H+ / H2 ; S2O82- / SO42- ; O2 / H2O et H2O / H2
-A la cathode : 2 H+(aq) + 2e- = H2 (g) réduction
L'expérience montre un dégagement gazeux inflammable.
-A l'anode, il y a 2 possibilités : 2 SO42-(aq) = 2 e- + S2O82-(aq)
ou 2 H2O(l) = O2 (g) + 4 H+(aq) + 4 e-
L'expérience montre un dégagement gazeux, c'est donc la 2ème oxydation qui
a lieu.
-Bilan : 2 H2O(l) = O2 (g) + 2 H2 (g)
On retrouve les proportions de gaz dans les volumes de gaz recueilli dans les tubes.

IV- Calcul de quantité de matière :
On utilise les mêmes formules que pour les piles : Q = I . t ; Q = n(e- ).F ; 1 F = NA.e
On tient compte des demi-équations aux électrodes pour déterminer les quantités de matière produites et
consommées, par exemple :
-Pour l'électrolyse de la solution de chlorure de sodium : A l'anode : 2 Cl-(aq) = 2 e- + Cl2 (g)
F
tI
F
Qen
Clnformé .2.
.22 )(
)( 2
-Pour l'électrolyse de la solution d'acide sulfurique : A l'anode : 2 H2O(l) = O2 (g) + 4 H+(aq) + 4 e-
F
tI
F
Qen
On formé .4.
.44 )(
)( 2
V. Quelques applications de l'électrolyse.
Voici quelques domaines d'utilisations de l'électrolyse.
Préparation ou purification de certains métaux: le zinc et l'aluminium sont préparés par électrolyse d'une
solution contenant leurs cations ou leurs oxydes. Le cuivre est purifié par électrolyse à anode soluble. (Cette liste
n'est pas exhaustive).
Préparation de substances non métalliques: Le dichlore (ainsi que petite proportion de dihydrogène) et la
soude sont préparés par électrolyse d'une saumure (solution très concentrée de chlorure de sodium).
Dépôts de métaux sur un support: Ils se font par électrolyse à anode soluble. L'électrolyte contient les cations
du métal à déposer. La cathode est constituée de l'objet (métallisé) à recouvrir. La galvanoplastie a pour but de
reproduire un objet, la galvanostégie a pour but de le protéger.
Les accumulateurs ou les piles rechargeables font intervenir l'électrolyse lors de la phase de recharge.
VI. Les accumulateurs.
1. Définition.
Un accumulateur est un système chimique. Il peut:
Fournir de l'énergie électrique à un circuit extérieur lorsqu'il évolue de façon spontanée. Il fonctionne
alors en générateur et fait passer dans ce circuit extérieur un courant dont le sens est imposé par la
transformation chimique spontanée. L'accumulateur se décharge.
Fonctionner en récepteur lorsqu'on le branche aux bornes d'un générateur qui impose un sens de courant
inverse du précédent. Le système évolue alors dans le sens contraire de son sens d'évolution spontanée.
L’accumulateur se charge.
2. Exemple: l'accumulateur au plomb
(batterie d'automobile).
a. Schéma de principe.
Le schéma ci-dessous représente un
accumulateur au plomb pendant la phase de
décharge.
b. Equations aux électrodes et bilan
électrochimique pendant la décharge.
-A la borne positive:
PbO2+ 4H+ + 2e- =Pb2+ + 2H2O soit:
PbO2 + SO42- + 4H+ + 2e- = PbSO4 + 2H2O
-A la borne négative:
Pb = Pb2+ + 2e- soit:
Pb + SO42- = PbSO4 + 2e-
-Bilan électrochimique:
PbO2 + 2SO42- + 4H+ + Pb = 2PbSO4 + 2H2O
Pendant la charge, la réaction se déroule
dans le sens inverse et les réactifs sont
régénérés. La f.é.m. est de l'ordre de 2V.
VII. Réactions spontanées et réactions forcées dans le monde vivant.
Il existe en chimie et en biochimie des réactions spontanées et des réactions forcées qui ne relèvent pas d'un
processus électrolytique. Par exemple: la respiration et la photosynthèse chlorophyllienne.
-La respiration : C'est un processus biologique dont le déroulement complexe passe par la dégradation d'un
nutriment organique. Il apparaît une succession de réactions d'oxydoréduction mettant en jeu le dioxygène. Elle
a, entre autres, pour effet de synthétiser la molécule d'ATP, réservoir d'énergie des cellules. Par exemple:
C6H12O6 + 6O2 = 6CO2 + 6H2O ; C'est une réaction spontanée dans le sens direct.
-La synthèse chlorophyllienne.
Il s'agit de la synthèse de matière organique avec l'aide de la lumière par les végétaux dits"chlorophylliens".
6CO2 + 6H2O = C6H12O6 + 6O2 ; Il s'agit de la réaction inverse de la précédente (respiration). C'est donc
nécessairement une réaction forcée. L'énergie nécessaire est apportée par la lumière.
1
/
3
100%