Adaptations métaboliques et hormonales à l'exercice

L
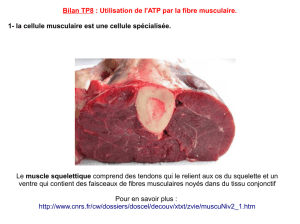
es muscles squelettiques représentent environ 40 % du
poids corporel et consomment 30 à 35 % de l’oxygène
au repos. Leur mise en jeu au cours de l’exercice
s’accompagne de modifications physiologiques complexes devant
répondre à un double objectif métabolique : satisfaire les besoins
accrus générés par la contraction musculaire et assurer l’homéo-
stasie énergétique, notamment glucidique, du reste de l’organisme
et, tout particulièrement, du système nerveux central.
Ainsi, aux adaptations cardiovasculaires et respiratoires, assu-
rant essentiellement une fonction de transport et d’apport en oxy-
gène, s’associent des adaptations métaboliques régulées par un
système neurohormonal complexe. L’exploration de l’aptitude
physique, largement répandue chez le sujet sain comme chez le
malade, s’intéresse principalement aux adaptations cardiorespi-
ratoires et méconnaît souvent les adaptations métaboliques et hor-
monales. Ces dernières sont pourtant primordiales et condition-
nent en grande partie les performances musculaires et la
récupération. Elles peuvent être altérées dans de nombreuses
pathologies mais également chez le sujet sédentaire, et varient
considérablement selon la nature de l’exercice (intensité, durée,
type). Cette mise au point s’intéresse aux principales caractéris-
tiques des adaptations métaboliques et neurohormonales au cours
de l’activité physique.
Après un rappel du métabolisme énergétique musculaire et des
contraintes métaboliques générées par l’exercice, nous envisa-
gerons les principaux mécanismes neurohormonaux mis en jeu
en réponse à ces contraintes. Enfin, les effets de l’entraînement
et du déconditionnement musculaire sur les adaptations métabo-
liques et hormonales à l’effort seront abordés.
MISE AU POINT
Adaptations métaboliques et hormonales
au cours de l’exercice
●
A. Pérez-Martin*
171
La Lettre du Pneumologue - Volume V - no5 - sept.-oct. 2002
* Centre d’exploration et de réadaptation des anomalies métaboliques et
musculaires (CERAMM), service central de physiologie clinique, CHU Lapeyro-
nie, Montpellier.
Points forts
•Le renouvellement de l’ATP musculaire peut se faire selon différentes voies métaboliques, la voie aérobie étant la plus rentable
et la plus durable.
•La réponse métabolique et hormonale au cours de l’exercice doit répondre à une double contrainte : maintenir la glycémie et
satisfaire les besoins énergétiques musculaires accrus.
•Le système sympathique est le premier à intervenir. Il inhibe l’insulinosécrétion et stimule la glycogénolyse.
•La réponse hormonale associe la baisse de l’insuline et l’augmentation des hormones de contre-régulation ; elle génère divers
processus métaboliques :
–augmentation de la production hépatique de glucose résultant de l’accroissement de la glycogénolyse (baisse de l’insuline,
des catécholamines et du glucagon) et de la néoglucogenèse (baisse de l’insuline, du glucagon, du cortisol et de l’hormone de
croissance) ;
–augmentation de la glycogénolyse musculaire (baisse de l’insuline, des catécholamines) ;
–augmentation de la lipolyse (baisse de l’insuline, des catécholamines, du glucagon, du cortisol et de l’hormone de croissance).
•Le cortisol a, de plus, un rôle catabolisant protidique qui permet d’alimenter la néoglucogenèse, notamment pendant la récu-
pération, tandis que les hormones thyroïdiennes jouent un rôle “permissif”.
•L’entraînement favorise l’oxydation lipidique et l’épargne glycogénique. Il atténue la réponse neurohormonale, grâce à une
meilleure sensibilité hormonale.
•Inversement, la sédentarité et certaines maladies chroniques se caractérisent par une moindre capacité oxydative et une
orientation du métabolisme musculaire vers la voie glycolytique. Ces anomalies musculaires sont un facteur de mauvaise tolé-
rance à l’effort, mais elles sont généralement réversibles sous l’effet du réentraînement.

Figure 1. Contraintes métaboliques au repos et à l’effort.
Les besoins énergétiques et glucidiques du système nerveux central (SNC)
restent constants au repos et lors de l’exercice physique. Les adaptations
métaboliques et hormonales doivent donc répondre à une double
contrainte : maintenir les apports au SNC tout en répondant à la demande
énergétique des muscles sollicités par l’activité physique. La demande éner-
gétique est variable selon le type de l’exercice, sa durée et son intensité.
REPOS
Glucose
6 g/h
O2
Système nerveux central
Muscles
AGNE
6 g/h
EXERCICE
Glucose O2
Système nerveux central
Muscles
AGNE
FLUX MÉTABOLIQUES
AU COURS DE L’EXERCICE MUSCULAIRE
Contraintes métaboliques
Au cours de l’exercice musculaire, l’organisme doit faire face à
une double contrainte métabolique : d’une part, répondre à la
demande énergétique des muscles en activité et, d’autre part, assu-
rer l’homéostasie glucidique.
L’importance du maintien de la glycémie est attestée par la com-
plexité de sa régulation et cet objectif paraît prioritaire, de façon
à satisfaire les besoins constants des organes “glucose-dépen-
dants”, notamment le système nerveux central (figure 1). Un
double contrôle neurovégétatif et hormonal permet d’équilibrer
en permanence la balance glucidique : l’augmentation de la cap-
tation et de l’utilisation musculaire du glucose par le muscle est
ainsi contrebalancée par une élévation de la libération de glucose
dans le sang, essentiellement à partir du foie. Parallèlement, la
mobilisation d’autres substrats énergétiques, au premier rang des-
quels les lipides sous forme d’acides gras non estérifiés (AGNE),
utilisables par le muscle de façon alternative, permet à la fois une
“épargne glucidique” et un apport énergétique satisfaisant aux
muscles sollicités par l’exercice.
Le système de régulation impliqué est redondant mais il peut, ce-
pendant, être parfois dépassé. Le non-respect de l’un des objectifs
métaboliques (maintien de la glycémie et/ou apports énergétiques
musculaires adaptés) conduit rapidement à l’épuisement du sujet.
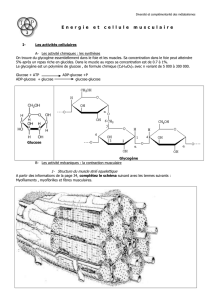
Métabolisme énergétique musculaire
et substrats énergétiques
L’énergie nécessaire à la contraction musculaire est fournie par
l’hydrolyse de l’adénosine triphosphate (ATP), qui est indispen-
sable au fonctionnement du système actine-myosine et au recap-
tage des ions calcium par le réticulum endoplasmique. Les
réserves intracellulaires étant très faibles (5 mmol/kg de muscle),
l’ATP doit être constamment renouvelée pour maintenir la
contraction. Cette resynthèse peut se faire par différents proces-
sus, dont le rendement, le débit et les conditions de mise en jeu
varient considérablement (tableau I).
La voie anaérobie alactique permet la resynthèse d’ATP à par-
tir de composés phosphorés riches en énergie et immédiate-
ment disponibles dans le muscle : la créatine phosphate (CP) et
l’adénosine diphosphate (ADP). Ce processus est rapidement
mis en jeu et permet des exercices d’intensité élevée, mais de
courte durée, en raison des faibles quantités de substrats dispo-
nibles (20 et 103mmol/kg de muscle respectivement pour la
CP et l’ADP).
Si l’exercice se poursuit, d’autres processus métaboliques sont
sollicités. Ainsi, au-delà des premières secondes d’exercice, la
voie anaérobie lactique (ou glycolyse anaérobie) est mise en jeu.
Elle correspond à la dégradation cytosolique du glycogène mus-
culaire et, dans une moindre mesure, du glucose circulant capté
MISE AU POINT
172
La Lettre du Pneumologue - Volume V - no5 - sept.-oct. 2002
Tableau I. Voies métaboliques de renouvellement de l’ATP.
Voies métaboliques Rendement (ATP mol
–1
substrat) ATP mol
–1
O
2
Voie anaérobie alactique (durée de la réserve d’énergie : 5-7 secondes) Composés phosphorés 1 –
Voie anaérobie lactique (durée de la réserve d’énergie : 30-50 secondes) Glycogène lactate 3 –
Glucose lactate 2 –
Voie aérobie (durée de la réserve d’énergie : 5-7 secondes) Lactate CO
2
+ H
2
O17 5,7
Glycogène CO
2
+ H
2
O37 6,2
Glucose CO
2
+ H
2
O36 6,0
AGNE CO
2
+ H
2
O 138 5,6

Figure 2. Dégradation de l’acétyl-co-enzyme A par le cycle de Krebs.
Le cycle de Krebs se déroule dans la matrice mitochondriale et comporte
une séquence organisée de réactions enzymatiques dont le substrat
initial et final est l’acide oxaloacétique. Il est “alimenté” par le produit
final du catabolisme des nutriments, l’acide acétique, dont le radical acé-
tyl se combine avec le co-enzyme A (co-A). L’acétyl-co-A ainsi formé cède
le radical acétyl à l’acide oxaloacétique, ce qui permet d’initier une série
de réactions d’oxydation qui transforment chaque radical acétyl en deux
molécules de CO
2
, huit atomes d’hydrogène (H
+
) et huit électrons (e
–
).
Acétyl-coA
Oxaloacétate
Malate Isocitrate
NAD
+
NADH
NAD
+
NADH
FAD
FADH
2
Citrate Cis-aconitate
Furamate Succinate acétoglutarate
NAD
+
NADH
par le muscle en pyruvate. Ce dernier, en l’absence d’oxygène,
est réduit en lactate. Cette voie intervient avec une durée d’effi-
cacité plus grande que la voie anaérobie alactique, mais avec un
rendement moindre. Il faut souligner que la glycolyse anaérobie
est essentiellement développée dans les fibres musculaires à fort
potentiel glycolytique (type IIb), où elle fonctionne même quand
l’apport en oxygène est satisfaisant. Son principal facteur limi-
tant tient à l’apparition d’une acidose musculaire par accumula-
tion d’acide lactique et épuisement des capacités cellulaires à
tamponner les ions H+.
Lorsque l’exercice se prolonge, la voie aérobie est à son tour sol-
licitée, tout particulièrement dans les fibres musculaires à fort
potentiel oxydatif (type I). Elle n’est possible qu’en présence
d’une quantité suffisante d’oxygène, c’est-à-dire lorsque les adap-
tations respiratoires et cardiovasculaires sont mises en place.
Aussi n’atteint-elle son efficacité maximale que pour des efforts
prolongés au-delà de trois minutes. Elle se caractérise par un fort
rendement et par l’utilisation possible de différents types de sub-
strats énergétiques. Elle comporte plusieurs étapes.
Tout d’abord, la dégradation des nutriments aboutit à la forma-
tion d’acétyl-coenzyme A qui alimente le cycle citrique de Krebs.
Chaque tour de cycle forme deux molécules de CO2et libère des
électrons et des atomes d’hydrogène qui réduisent le nicotina-
mide-adénine-dinucléotide (NAD) et le flavine-adénine-dinu-
cléotide (FAD) en NADH et FADH2(figure2). NADH et FADH2
agissent comme de véritables agents de transfert et vont céder
des électrons à haute énergie et des protons aux complexes de la
chaîne respiratoire (figure3). Cette dernière est constituée d’une
quinzaine de transporteurs localisés dans la membrane interne de
la mitochondrie. Les différentes étapes de cette chaîne sont accé-
lérées par trois gros complexes enzymatiques enchâssés dans la
membrane : l’ubiquinone, les cytochromes et le système de la
cytochrome-oxydase. Le transport des électrons le long de la
chaîne respiratoire libère de l’énergie, qui permet l’exportation
de protons dans l’espace intermembranaire, créant ainsi un gra-
dient électrochimique (mécanisme chimio-osmotique). L’éner-
gie ainsi stockée est utilisée pour :
–activer l’ATP-synthétase qui catalyse la phosphorylation de
l’ADP en ATP et qui est dotée d’un canal à protons ;
–transporter divers métabolites à travers la membrane mito-
chondriale.
Cette énergie permet notamment le fonctionnement de la trans-
locase qui assure l’antiport spécifique ADP-ATP (l’entrée d’ADP
étant couplée à la sortie d’ATP).
À la fin de la chaîne respiratoire, le complexe cytochrome-oxy-
dase assure la réduction de l’oxygène moléculaire, qui représente
l’accepteur final d’électrons. Cette réaction aboutit à la forma-
tion d’eau (figure 3).
Pour assurer les besoins énergétiques cellulaires, le fonctionne-
ment de la chaîne respiratoire est étroitement régulé. C’est le
contrôle respiratoire, assuré par divers mécanismes :
–la disponibilité en ADP et en Piqui module l’intensité respi-
ratoire et la consommation d’O2;
–les rapports intramitochondriaux ATP-ADP qui conditionnent
le fonctionnement de la cytochrome-oxydase (un rapport élevé
étant inhibiteur) ;
173
La Lettre du Pneumologue - Volume V - no5 - sept.-oct. 2002
–le monoxyde d’azote (NO) ; à faible concentration, le NO
inhibe la chaîne respiratoire en entrant en compétition avec l’O2
au niveau de la cytochrome-oxydase ;
–enfin, certains signaux intracellulaires, en particulier le taux
de calcium, participent aussi au contrôle respiratoire. Une élé-
vation du calcium libre intramitochondrial active la déshydrogé-
nase du cycle de Krebs, augmente la production de NADH, le
flux d’électrons et, en conséquence, la synthèse d’ATP.
La production mitochondriale d’ATP est ainsi étroitement liée
aux besoins énergétiques de la cellule. La régulation fine des flux
énergétiques implique d’ailleurs diverses structures cellulaires
(consommant ou générant de l’énergie), notamment les myofi-
brilles, les mitochondries et le réticulum endoplasmique. Ces dif-
férents intervenants s’organisent en une véritable “unité fonc-
tionnelle énergétique”, qui permet de réguler non seulement le
niveau de production d’ATP, mais aussi la distribution des mito-
chondries au sein de la cellule (1) (figure 4).
En théorie, les trois types de nutriments (glucides, lipides et pro-
tides) sont utilisables par voie aérobie. En fait, les substrats glu-
cidiques et lipidiques constituent l’essentiel des ressources éner-
gétiques, les protéines n’y participant que de façon négligeable
dans les conditions habituelles d’exercice. Elles représentent
pourtant une réserve potentielle d’énergie, grâce à l’oxydation
de l’alanine et à leur rôle de substrat de la néoglucogenèse. Leur
contribution reste cependant faible, sauf dans les conditions
extrêmes où leur catabolisme peut atteindre 4 à 7 g/h (2).
Les principaux substrats glucidiques assurant la couverture des
besoins énergétiques au cours de l’exercice sont :
–le glycogène, dont les réserves musculaires sont utilisées pré-
férentiellement au stock hépatique ;
–le glucose circulant, qu’il soit d’origine exogène ou hépatique
(glycogénolyse et néoglucogénèse) ;

Figure 3. Respiration mitochondriale (ou oxydoréduction phosphorylante).
Les électrons (e
–
) et les atomes d’hydrogène (H
+
) libérés à chaque “tour” du cycle de Krebs réduisent des “accepteurs” nicotinamide-adénine-dinu-
cléotide (NAD
+
) et flavine-adénine-dinucléotide (FAD) en NADH et FADH
2
respectivement. Le NADH régénère NAD
+
et libère un proton et deux élec-
trons à haut potentiel d’oxydoréduction. Ce potentiel diminue graduellement le long d’une séquence d’une quinzaine de transporteurs situés dans la
membrane interne de la mitochondrie et constituant la chaîne respiratoire. Le transfert des électrons jusqu’à leur accepteur final, l’O
2
moléculaire, se
fait par une série d’oxydoréductions impliquant plusieurs couples redox ordonnés en chaîne. Les principales étapes de cette chaîne sont accélérées par
trois gros complexes enzymatiques enchâssés dans la membrane : l’ubiquinone, qui transmet les électrons du complexe I au complexe III ; les cyto-
chromes, dont le cytochrome c, qui assure le transfert d’électrons du complexe III au complexe IV ; le système de la cytochrome oxydase au niveau de
laquelle quatre électrons passent sur une molécule d’O
2
moléculaire directement réduite en eau, moyennant deux protons.
L’énergie libérée lors de chaque combinaison des électrons avec les différents complexes est utilisée pour l’exportation de protons dans l’espace inter-
membranaire, créant ainsi un gradient électrochimique (mécanisme chimio-osmotique). L’énergie contenue dans ce gradient protonique permet notam-
ment le fonctionnement de l’ATP-synthétase mitochondriale. Cette enzyme comporte un canal à protons ancré dans la membrane (F0) et un complexe
de couplage F1, localisé sur la face matricielle et qui catalyse la production d’ATP. Le flux de protons traversant l’ATPase développe une force pho-
tomotrice qui est transformée en énergie mécanique (rotation de l’unité F1) puis chimique, par modification de conformation des sites catalytiques de
F1, permettant ainsi la phosphorylation de l’ADP en ATP. L’ATP formé ne peut sortir de la mitochondrie que si de l’ADP y entre, par un système
d’antiport spécifique assuré par l’ATP-ADP translocase.
–le lactate, issu de la glycolyse anaérobie qui alimente la néo-
glucogenèse hépatique, mais dont la principale voie d’élimina-
tion au cours de l’exercice et de la récupération est l’oxydation
par les fibres de type I.
Les lipides, utilisés sous forme d’AGNE et de triglycérides, re-
présentent une source énergétique abondante dans le tissu
adipeux, mais également dans le muscle. Leur utilisation est
avantageuse, car elle a un fort rendement et permet une épargne
glycogénique.
L’utilisation préférentielle des glucides ou des lipides est condi-
tionnée par divers facteurs parmi lesquels la durée, l’intensité de
l’exercice et le niveau d’entraînement préalable s’avèrent être
trois déterminants majeurs (3). D’un point de vue chronologique,
l’utilisation des substrats énergétiques peut se schématiser ainsi :
MISE AU POINT
174
La Lettre du Pneumologue - Volume V - no5 - sept.-oct. 2002
Cycle de Krebs
Acétyl-coA
Pyruvate
Acides gras
NADH
NAD FAD
NADH FADH2
ADP
+ Pi ATP
ADP ADP
ATP
H2O
H2O
O2
e–
e–
e–
e–
H+
H+
IV
FADH2Coenzymes réduites
Membrane
interne
Espace
intermembranaire
Ubiquinone Cytochrome c
Cytochrome
déshydrogénase
ATP-synthétase
Translocase
H+
III
b-cl
H+
H+
H+H+H+
F0
F1
Gradient
protonique
H+
H+
H+
II
Succino-
déshydrogénase
H+
I
NADH
déshydrogénase
Pi Pi

durant les dix premières minutes de l’exercice, le glycogène mus-
culaire représente la principale source d’énergie ; au-delà, le
maintien des contractions musculaires impose l’utilisation du glu-
cose et des AGNE circulants, la part respective de ces derniers
augmentant avec la durée de l’effort (4) (figure 5). L’intensité
d’exercice est aussi un important déterminant de la balance éner-
gétique à l’effort : à faible intensité, les lipides sont la principale
source d’énergie musculaire, tandis que l’augmentation de puis-
sance s’accompagne d’une utilisation préférentielle des substrats
glucidiques, au détriment de l’oxydation lipidique. Différents
mécanismes concourent à ce phénomène : la glycogénolyse mus-
culaire induite par les contractions, le recrutement croissant de
fibres glycolytiques et l’exacerbation de la réponse adrénergique,
dont les effets métaboliques sont détaillés plus loin. Le rôle de
l’entraînement sur la balance glucidolipidique à l’effort sera
détaillé ultérieurement.
ADAPTATIONS NEUROHORMONALES
La réponse physiologique coordonnée est gouvernée par deux
systèmes en interrelation : le système neurovégétatif (et plus spé-
cifiquement la composante sympathique) et le système hormo-
nal. L’amplitude de cette réponse est largement conditionnée par
la nature de l’exercice réalisé et son but est, rappelons-le, de satis-
175
La Lettre du Pneumologue - Volume V - no5 - sept.-oct. 2002
Figure 4. Unité fonctionnelle énergétique dans la cellule musculaire.
Selon le modèle proposé par Saks et al. (1), chaque sarcomère (ou groupe de sarcomères voisins) possède son propre système de production énergétique
et de régulation, constituant une unité fonctionnelle énergétique (intracellular energetic unit, ICEU). Le réticulum sarcoplasmique et les mitochondries,
en étroite interrelation avec des éléments du cytosquelette, s’agencent ainsi à proximité des myofibrilles, entre deux stries Z, c’est-à-dire entre deux
tubules T. Le réticulum sarcoplasmique libère du Ca
2+
à l’intérieur de l’ICEU, au voisinage des myofibrilles et des mitochondries. Le Ca
2+
active alors,
d’une part, la contraction musculaire et, d’autre part, différentes déshydrogénases mitochondriales. Par ailleurs, les taux d’adénosine nucléotide conte-
nus au sein de l’ICEU ne s’équilibrent pas directement avec ceux du reste du cytosol. Ils font l’objet d’échanges très rapides, via diverses réactions
enzymatiques intermédiaires. L’ADP entre ainsi dans divers processus métaboliques impliquant notamment l’adénylate kinase (AK) et la créatine kinase
(CK) avec l’intervention de la navette phospho-créatine (PCr)/créatine (Cr). Il est d’ailleurs intéressant de noter la distribution de la CK sur les diffé-
rents constituants de l’ICEU. Ces diverses voies métaboliques constituent de véritables systèmes de transfert énergétique, empêchant l’accumulation
d’ADP et permettant la régulation de la production mitochondriale d’ATP, finement ajustée aux besoins énergétiques cellulaires. Elles permettent des
interrelations étroites entre les différents constituants de l’ICEU, en ajustant précisément et rapidement les flux énergétiques aux besoins cellulaires.
AMP = adénosine monophosphate.
Myofibrilles
TUBULE T
TUBULE T
H+
STRIES Z
STRIES Z
Unité fonctionnelle énergétique dans la cellule
ATP
ATP
ATP
Pi
ATP
ATP
AMP
AMP
ATP
ATPase
ADP
ADP
ADP
ADP
ADP
ADP
ADP
Pi
H+
H+
H+
AK AK
CK
CK
ATP-
synthétase
Cr
Ca2+
Ca2+
Ca2+
Ca2+
Ca2+
Ca2+
PCr
Membrane
interne
Membrane
externe
Réticulum
sarcoplasmique
Mitochondrie
Cr
PCr CK
 6
6
 7
7
 8
8
 9
9
1
/
9
100%