PROHIPPUR 750 mg/g, granulés

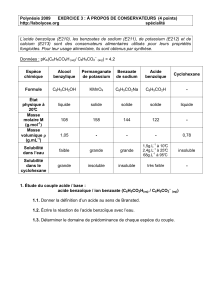
ANSM - LUCANE PHARMA Févier 2017 version 1
ATUc PROHIPPUR
RESUME DES CARACTERISTIQUES DU PRODUIT
1. DENOMINATION DU MEDICAMENT
PROHIPPUR 750 mg/g, granulés
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Benzoate de sodium ............................................................................................................ 750 mg
pour 1 g de granulés
Excipients à effet notoire :
160 mg (6.9 mmol) de sodium par gramme de benzoate de sodium administré.
Pour la liste complète des excipients, voir rubrique 6.1.
3. FORME PHARMACEUTIQUE
Granulés de couleur blanche à blanchâtre.
4. DONNEES CLINIQUES
4.1. Indications thérapeutiques
PROHIPPUR est indiqué comme traitement adjuvant dans la prise en charge au long cours de
- de l’hyperglycinémie sans cétose,
- des désordres du cycle de l’urée, incluant un déficit en carbamylphosphate synthétase, ornithine
transcarbamylase, argininosuccinate synthétase, arginosuccinate lyase, arginase, ou n-acetylglutamate
synthase et intolérance aux protéines lysinuriques ou syndrome d’hyperornithinémie-
hyperammoniémie-homocitrullinurie, en cas d’échec, d’insuffisance thérapeutique, d’intolérance ou de
contre-indication aux autres traitements épurateurs d’azote.
Il est indiqué dans les troubles du cycle de l’urée de toute forme : à révélation néonatale (déficit
enzymatique complet se révélant dans les 28 premiers jours de vie), ou à révélation tardive (déficit
enzymatique partiel s’exprimant après le premier mois de vie) avec antécédents d'encéphalopathie
hyperammoniémique.
4.2. Posologie et mode d'administration
Le traitement par PROHIPPUR doit être supervisé par un médecin ayant l'expérience du traitement de
l’hyperglycinémie sans cétose et/ou des désordres du cycle de l'urée.
Posologie
Hyperglycinémie sans cétose :
La dose de départ recommandée est de 200 mg/kg/jour pour les patients présentant des symptomes
légers et de 500 mg/kg/jour dans le cas de symptomes sévères. Pour des raisons de tolérance, la dose
de benzoate doit être augmentée progressivement, par incrément de 50 mg/kg/jour par exemple, les
taux plasmatiques de glycine et de benzoate devant être contrôlés avant toute modification de la
posologie. La dose quotidienne maximale doit être inférieure à 750 mg/kg/jour.
Troubles du cycle de l’urée,
La dose quotidienne doit être ajustée individuellement en fonction de la tolérance du patient aux
protéines, de la prise concomitante d’autres chélateurs d’azote, et des apports quotidiens en protéines
d’origine alimentaire nécessaires à sa croissance et son développement. Les doses quotidiennes
couramment utilisées en clinique vont de 250 à 500 mg/kg/jour, et le plus souvent sont de
250 mg/kg/jour. Une dose orale de 250 à 500 mg/kg/jour devrait éliminer 1,7 à 3,5 mmol/kg/jour d’azote
sous forme d’hippurate, pour un excès d’azote de 6,5 mmol/kg/jour, et par conséquent une élimination
de l’excès d’azote restant nécessiterait l’addition d’un autre épurateur. .

ANSM - LUCANE PHARMA Févier 2017 version 1
ATUc PROHIPPUR
Surveillance thérapeutique
Selon l’indication, les taux plasmatiques de sérine et de glycine, ou d’ammoniaque, d’arginine, des
acides aminés essentiels, de carnitine et des protéines sériques doivent être maintenus dans les limites
de la normale et celui de glutamine à des taux inférieurs à 1000 μmol/L.
Surveillance nutritionnelle
Dans les cas sévères d’hyperglycinémie sans cétose associée à un indice glycinique élevé, un régime
limité en glycine doit être mis en place. Ce régime n’est pas nécessaire chez les patients présentant un
faible indice glycinique.
Dans les désordres du cycle de l’urée, PROHIPPUR doit être associé à un régime hypoprotidique et
dans certains cas, à une supplémentation en acides aminés essentiels et en carnitine.
Dans les formes néonatales par déficit en carbamylphosphate synthétase ou en ornithine
transcarbamylase, une supplémentation en citrulline ou en arginine est nécessaire à la dose de
0,17 g/kg/jour ou 3,8 g/m²/jour.
Dans le déficit en argininosuccinate synthétase, la supplémentation en arginine est nécessaire à la dose
de 0,4 à 0,7 g/kg/jour ou 8,8 à 15,4 g/m²/jour.
Si une supplémentation calorique est indiquée, il est recommandé d'utiliser une préparation dépourvue
de protéines.
Population particulière
Insuffisance hépatique ou rénale
Le benzoate de sodium étant métabolisé et excrété par le foie et les reins, PROHIPPUR doit être utilisé
avec précaution chez les patients atteints d'insuffisance hépatique ou rénale.
Mode d’administration
PROHIPPUR est administré par voie orale.
En l’absence d’informations, PROHIPPUR ne doit pas être administré par sonde nasogastrique ou de
gastrostomie.
La dose quotidienne totale doit être répartie en prises égales et être administrée lors de chaque repas
ou prise alimentaire (par exemple 4 à 6 fois par jour chez le jeune enfant). Les granulés peuvent être
directement avalés à l’aide d’une boisson (eau, de jus de fruit, ou de préparations infantiles sans
protéines) ou saupoudrés sur une cuillère à soupe d'aliments solides (purée ou compote de pomme)
sans être dissous. Dans ce cas, il est important que la prise soit immédiate afin de préserver le
masquage du goût.
Une cuillère-mesure graduée, permettant de mesurer jusqu'à 5 g de benzoate de sodium par incrément
de 250 mg, est fournie.
4.3. Contre-indications
Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
Grossesse.
Allaitement.
4.4. Mises en garde spéciales et précautions d'emploi
Teneur en électrolytes cliniquement importants
PROHIPPUR contient 160 mg (6,9 mmol) de sodium par gramme de benzoate de sodium.
PROHIPPUR doit donc être utilisé avec précaution chez les patients atteints d'insuffisance
cardiaque congestive ou d'insuffisance rénale sévère, et dans les affections cliniques impliquant
une rétention sodée et des oedèmes.
Considérations générales
Même sous traitement, une encéphalopathie hyperammoniémique aiguë peut survenir chez un
certain nombre de patients.
PROHIPPUR n’est pas recommandé dans la prise en charge de l’hyperammoniémie aiguë, qui
est une urgence médicale.
Excipients à effet notoire
Ce médicament contient du sodium dont il faut tenir compte pour les patients qui suivent un régime
contrôlé en sodium.

ANSM - LUCANE PHARMA Févier 2017 version 1
ATUc PROHIPPUR
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
L’administration d’acide salicylique avant le benzoate n’a aucun effet sur l’élimination de l’hippurate. Le
salicylate n’a aucun effet sur la proportion d’acide hippurique et de glucuro-benzoyle excrétée dans
l’urine après administration de benzoate, de même que sur la constante de vitesse d’excrétion de l’acide
hippurique. Inversement, l’excrétion de l’acide salicylurique est diminuée après l’administration de
benzoate qui a un effet inhibiteur important, rapide, bref, et dose-dépendant sur la formation de
salicylurate.
Le benzoate ne s’accumule pas chez les patients atteints d’insuffisance rénale chronique.
Chez les patients atteints de cirrhose, la conversion du benzoate en hippurate est légèrement
prolongée, ce qui suggère que la capacité de la voie métabolique du benzoate est sensiblement réduite
dans cette population de patients.
4.6. Grossesse et allaitement
Grossesse
La sécurité d’emploi de ce médicament au cours de la grossesse n’a pas été établie. L’évaluation des
données animales expérimentales a montré des effets sur la reproduction, notamment des effets sur le
développement de l’embryon et du fœtus. Des effets foetotoxiques et tératogénes sont apparus chez le
rat après une exposition prénatale au benzoate de sodium par injection intrapéritonéale à
100 mg/kg/jour. De telles lésions ne sont pas apparues par voie orale.
La signification de ces données pour la femme enceinte n'est pas connue ; par conséquent, l'utilisation
de PROHIPPUR est contre-indiquée pendant la grossesse (voir rubrique 4.3).
Allaitement
L'excrétion de benzoate de sodium ou de ses métabolites dans le lait maternel n'a pas été étudiée chez
l’homme et par conséquent, l'utilisation de PROHIPPUR au cours de l'allaitement est contre-indiquée
(voir rubrique 4.3).
Fertilité
Il n’y a pas de données disponibles concernant les effets du benzoate de sodium sur la fertilité.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Aucune étude n’a été menée sur la capacité à conduire des véhicules et à utiliser des machines.
4.8. Effets indésirables
Résumé du profil de sécurité
Dans les études publiées avec le benzoate de sodium, très peu de patients ont présenté un événement
indésirable et le lien entre ces événements indésirables et le benzoate de sodium n’a pas été évalué.
Tableau des effets indésirables
Les effets indésirables sont répertoriés ci-dessous par classe de systèmes d’organes et par fréquence.
La fréquence est définie comme : très fréquent (>1/10), fréquent (>1/100, <1/10), peu fréquent (>1/1
000, <1/100), rare (>1/10 000, <1/1 000), très rare (<1/10 000) et indéterminée (ne peut être estimée
sur la base des données disponibles). Au sein de chaque fréquence de groupe, les effets indésirables
doivent être présentés suivant un ordre décroissant de gravité.
Classe de systèmes d’organes
Fréquence
Effets indésirables
Affections psychiatriques
Peu
fréquent
anorexie
Affections du système nerveux
Peu
fréquent
vertiges,
convulsions, somnolence, coma
Affections gastro-intestinales
Fréquent
vomissements, nausées, dysgueusie, gastrite,
saignements gastriques, diarrhée
Affections du rein et des voies
urinaires
Peu
fréquent
dysfonction tubulaire rénale
Investigations
Peu
fréquent
Baisse de la concentration sanguine de carnitine,
Augmentation des concentrations sanguines de
bilirubine libre et des transaminases.

ANSM - LUCANE PHARMA Févier 2017 version 1
ATUc PROHIPPUR
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés est importante. Elle permet une surveillance continue
du rapport bénéfice/risque du médicament. Les professionnels de santé doivent déclarer tout effet
indésirable suspecté à l’aide de la fiche de déclaration des effets indésirables disponible dans le
Protocole d’utilisation thérapeutique et de recueil d’informations (cf. Annexe D du PUT).
4.9. Surdosage
Une patiente a reçu par erreur un volume d’une solution à 25 % de benzoate au lieu de 10 %. Dans les
18 heures qui ont suivi ces quatre administrations, la patiente a présenté un coma métabolique
acidosique, avec des vomissements, et nécessitant intubation/ventilation. Elle présentait une
hypernatrémie sévère, une hypokaliémie, un important déficit anionique, une hypocalcémie, et une
légère hyperammoniémie. Ses transaminases étaient normales et sa glycinémie faible. Le taux de
benzoate était de 15,4 mmol/L. Elle fut stabilisée par l’arrêt du benzoate, l’apport de glycine, de
potassium et calcium, et par hémodialyse. Tout de suite après la dialyse, le niveau de benzoate avait
une valeur inférieure à 0,1 mmol/L. Le matin suivant, la patiente était rétablie et le traitement repris.
Dans les cas de surdosage par inadvertance ou d’augmentation des doses intraveineuses de
l’association du benzoate et du phénylacétate, des cas d’hyperammoniémie associés à une toxicité
clinique symptomatique (anorexie, crises d’épilepsie augmentées, irritabilité, somnolence, et coma) ont
été rapportés. Sur vingt cas de surdosage, treize ont entrainé la mort, incluant deux cas de surdosage
massif (9 et 17 fois la dose recommandée) résumés dans le tableau suivant.
Description des surdosages de benzoate de sodium
Reference
(cases)
Benzoate
Symptômes
Médicament
Dose
(mg/kg/j)
Concentration
sanguine
(mmol/L)
Batshaw 1982
(2)
PA + BA
iv
800
8.54
Vomissements,
irritabilité
Brusilow 1984
(1)
-
-
Vomissements,
irritabilité
Praphanphoj
2000 (3)
2500
-
Mort
915 sur 12 h
10.6
Confusion-coma,
respiration de
Kussmaul, acidose
métabolique, œdème
cérébral (2), mort (2)
1750 sur 18 h
-
750 sur 10h
5.58
Van Hove 2005
(1)
BA
po ou iv
2.5 fois plus
haute
15.4
respiration de
Kussmaul, acidose
métabolique avec
coma
Enns 2007
(20)
PA + BA
iv
500-4380
-
13 morts
BA benzoate ; PA phénylacétate
Dans l’éventualité d’un surdosage, le traitement doit être interrompu et des mesures de soutien
introduites. Une hémodialyse peut être nécessaire.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : Divers produits à visée digestive et métabolique, code
ATC : A16AX11.
Mécanisme d’action et effets pharmacodynamiques
Le benzoate de sodium se lie avec la glycine par une réaction d’acétylation pour former de l’hippurate
qui est ensuite excrété par les reins. Sur une base molaire, l’hippurate est deux fois moins puissant que
l’urée (contenant 1 mole d’azote au lieu de 2) et par conséquent est une voie alternative seulement
partielle d’élimination de l’azote.

ANSM - LUCANE PHARMA Févier 2017 version 1
ATUc PROHIPPUR
Efficacité et sécurité clinique
Les symptômes de l’hyperglycinémie sans cétose se rapportent à l’activité de neurotransmetteur de la
glycine. La glycine agit comme un neurotransmetteur inhibiteur dans la moelle épinière et le tronc
cérébral, conduisant à une somnolence, une hypotonie, une apnée et un hoquet. La glycine agit comme
un neurotransmetteur excitateur dans le cortex au niveau du récepteur N-méthyl-D-aspartate (NMDA)
du glutamate, entrainant des secousses myocloniques, des crises d’épilepsie réfractaires et des lésions
cérébrales.
D’après des études basées sur l’excrétion de l’hippurate chez les patients atteints de désordres du cycle
de l’urée, il est possible d’estimer que pour chaque gramme de benzoate de sodium administré, entre
0,06 et 0,75 g d’azote sont transformés sous forme d’hippurate. En conséquence, le benzoate de
sodium contribue à réduire le niveau élevé d’ammoniaque dans le sang chez les patients souffrant de
désordres du cycle de l’urée et celui de la glycine chez les patients atteints d’hyperglycinémie sans
cétose. Il est important que le diagnostic soit fait rapidement et que le traitement démarre tôt pour
améliorer la survie et les résultats cliniques.
Pour les désordres du cycle de l’urée, PROHIPPUR peut s’avérer nécessaire à vie à moins que ne soit
décidée une transplantation hépatique orthotopique.
Population pédiatrique
L’évolution des formes néonatales des désordres du cycle de l’urée était autrefois presque toujours
fatale au cours de la première année de vie, même lorsque leur traitement comportait la dialyse
péritonéale et une supplémentation en acides aminés essentiels ou en leurs analogues dépourvus
d'azote. Avec l'hémodialyse, l'utilisation des voies alternatives d'élimination de l'azote (benzoate de
sodium, benzoate de sodium et phénylacétate de sodium), le régime hypoprotidique, et dans certains
cas une supplémentation en acides aminés essentiels, le taux de survie des nouveau-nés chez qui le
diagnostic a été posé après la naissance (mais au cours du premier mois de vie) a augmenté jusqu’à
atteindre près de 80 %, la plupart des décès survenant à l'occasion d'un épisode d'encéphalopathie
hyperammoniémique. L’incidence des retards mentaux reste élevée dans ces formes néonatales.
Dans les cas où le diagnostic a été posé pendant la période de gestation et le traitement débuté avant
tout épisode d'encéphalopathie hyperammoniémique, la survie est de 100 %, mais de nombreux
patients développent quand même par la suite des altérations cognitives ou d'autres déficits
neurologiques.
5.2. Propriétés pharmacocinétiques
Le benzoate se conjugue à la glycine pour former l’hippurate dans le foie et les reins.
Aucune étude formelle d’ADME n’a été conduite. Les concentrations plasmatiques et urinaires de
benzoate et de son métabolite (hippurate) ont été déterminées chez des adultes sains à jeun et chez
des malades atteints de désordres du cycle de l'urée ou d’hyperglycinémie sans cétose recevant des
doses orales uniques ou répétées.
Les concentrations plasmatiques et urinaires de benzoate et de ses métabolites ont été déterminées
chez des adultes sains à jeun après une dose unique de 40 à 160 mg/kg de benzoate de sodium et
chez des malades atteints de désordres du cycle de l'urée ou d’hyperglycinémie sans cétose après des
doses orales uniques ou répétées allant jusqu'à 750 mg/kg/jour (études non contrôlées). Le taux
d’élimination de l’hippurate est corrélé de façon linéaire à la concentration plasmatique. La concentration
plasmatique du benzoate non métabolisé après une administration orale est faible du fait d’un important
effet de premier passage.
Absorption
Après une administration orale à jeun, le benzoate de sodium est protoné et l’absorption de l’acide formé
(pKa=4,2) s’effectue rapidement. Après une dose orale de 40 à160 mg/kg de benzoate de sodium, le
niveau de benzoate plasmatique a été détecté dès15 à 30 minutes après l’administration. Le délai
moyen d’obtention de la concentration maximale est de de 0,5 à 1,8 heures et augmente avec la dose,
et la concentration moyenne maximale de 0,8 à 2,7 mmol/L. La demi-vie d'élimination a été estimée à
2 heures.
L’effet de la prise de nourriture sur l’absorption est inconnu.
Distribution
Les estimations du volume apparent de distribution du benzoate vont jusqu’à 80 L (contre 30 à 40 L
pour hippurate), en conformité avec le caractère plus lipophile du benzoate.
Biotransformation
La constante de clairance du benzoate est presque équivalente au flux sanguin hépatique, soit environ
750 ml/min (contre 300 ml/min pour l'hippurate, lui-même exclusivement éliminé par excrétion rénale).
Comme le métabolisme a lieu principalement dans le foie, il y a un effet de premier passage important
 6
6
 7
7
1
/
7
100%