10-Catabolisme d`amino-acides et protéines [Mode de

1
Catabolisme des
α
αα
α-aminoacides et des protéines
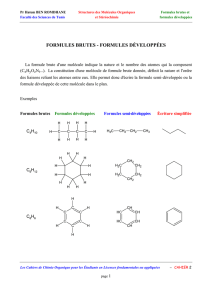
Formule générale des α
αα
α-aminoacides
Généralités
NH2-CH-COOH
R Chaîne latérale
Les protéines sont des polypeptides formés par des
enchaînements d’aminoacides
Les aminoacides occupent une position centrale
dans le métabolisme des composés azotés
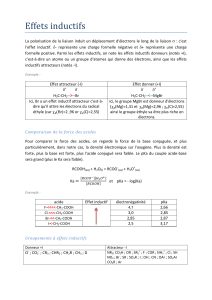
Principales réactions de dégradation des aminoacides?

2
Dégradation des aminoacides :
Élimination de l’azote : Principe
•Par transamination, l’azote de n’importe quel aminoacide est transféré sur le
glutamate de façon réversible.
•Le glutamate libère l’ammoniaque par une réaction d’oxydation
•La dégradation des aminoacides s’effectue dans la mitochondrie.
•Il existe une transaminase pour la majorité des aminoacides (1).
•Dans la cas contraire, une réaction transforme la chaîne latérale de
l’aminoacide pour en former un autre pour lequel il existe une transaminase
•(1) La transamination appartient donc aussi bien au catabolisme qu’à l’anabolisme
Élimination de l’azote des aminoacides
Réaction de transaminationRéaction de transamination
Enzyme: aminotransférases
(transaminases) dans le cytosol
Echange entre une fonction
amine d’un aminoacide et la
fonction cétone de l’α
αα
α-cétoglutarate
Coenzyme activateur:
Pyridoxal Phosphate (PLP)
Réaction réversible
Dégradation des aminoacides
COO
-
CHNH
2
R
COO
-
CO
R
COO
-
CO
CH
2
CH
2
COO
-
COO
-
CHNH
2
CH
2
CH
2
COO
-
αKG Glu
PLP

3
Structure du pyridoxal phosphate PLP
N
CCH
2
OP
CH
3
HO
H O
N
CCH
2
OP
CH
3
HOH
N
H
2
Pyridoxal phosphate
(PLP) Pyridoxamine phosphate
(PMP)
H
C
O
O
-
CHNH
2
R
C
O
O
-
CO
R
PLP PMP
α KGGlu
Mécanisme Réaction de ping – pong:
1 - fixation du substrat 1 au site
actif de l’enzyme, formation du
produit qui se détaché du site actif
2 - fixation du substrat 2 au site
actif de l’enzyme
Catabolisme des aminoacides
Coenzyme associé à
de nombreuses
enzymes agissant sur
des composés azotés
-transaminases
-isomérase
-décarboxylase
…
Elimination de l’azote du glutamate
Transformation du glutamate formé par dégradation des
protéines, ou de la transamination des AA, en α-cétoglutarate et
NH4+
Oxydation couplée à une hydrolyse
Enzyme: Déshydrogénase (Glutamate déshydrogénase)
Dégradation des aminoacides
Désamination oxydativeDésamination oxydative
NH
4+
NAD
+
NADHH
2
N CH
CH
2
CH
2
COOH
OC
CH
2
CH
2
COOH
COO
-
COO
-
H
2
O

4
Devenir de l’ammoniaqueDevenir de l’ammoniaque
Mise en réserve sous forme de glutamineMise en réserve sous forme de glutamine
Réaction couplée d’hydrolyse (ATP) et de condensation de
NH4+sur le glutamate (double transfert)
Dégradation des aminoacides
Elimination par le cycle de l’uréeElimination par le cycle de l’urée
H
2
N CH
CH
2
CH
2
C
OH
O
H
2
N CH
CH
2
CH
2
C
NH
2
O
NH
4+
ATP ADP + P
Glutamine synthétase
COOH COOH
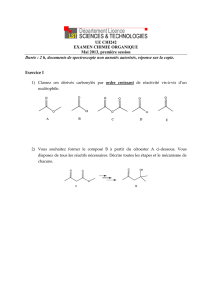
Dégradation du squelette carboné des aminoacides
Généralement, élimination de l’azote par transamination
et décarboxylation oxydative de l’α
αα
α-cétoacide formé:
-Les α-cétoacides formés sont des intermédiaires du cycle
de Krebs: pyruvate, α-cétoglutarate, OAA…
COOH
CHNH
2
CH
3
αKG Glu COOH
CO
CH
3
CH
3
COSCoA
NAD
+
NADH
CO
2
(PLP)
(LipSS, TPP, FAD)
Transaminase Déshydrogénase
HSCoA
Exemple

5
Dégradation des aminoacides et formation des
intermédiaires du catabolisme énergétique
1
/
5
100%