durela - Body1

DURELA®Monographie de produit (capsules de chlorhydrate de tramadol à libération prolongée) Page 1 of 36
MONOGRAPHIE DU PRODUIT
Pr DURELA®
Chlorhydrate de Tramadol
Capsules à libération prolongée 100, 200, 300 mg
Analgésique Opioïde
Fabricant :
Cipher Pharmaceuticals Inc.
5650 Tomken Road, Unit 16
Mississauga, Ontario
Canada, L4W 4P1
Importé et distribué par :
Medical Futures Inc.
16 Sims Crescent
Richmond Hill, Ontario
Canada, L4B 2P1
Date de préparation :
23 mai 2014
Numéro de contrôle de la présentation : 172079
Cette monographie de produit est la propriété exclusive de Cipher Pharmaceuticals Inc.
Il est interdit de la reproduire en tout ou en partie sans l'autorisation écrite de Cipher
Pharmaceuticals Inc.

DURELA®Monographie de produit (capsules de chlorhydrate de tramadol à libération prolongée) Page 2 of 36
Table des Matières
PARTIE I : RENSEIGNEMENTS POUR LES PROFESSIONNELS DE LA SANTÉ ................ 3
RENSEIGNEMENTS SOMMAIRES SUR LE PRODUIT.................................................. 3
INDICATIONS ET USAGE CLINIQUE ............................................................................. 3
CONTRE-INDICATIONS .................................................................................................... 4
MISES EN GARDE ET PRÉCAUTIONS ............................................................................ 4
EFFETS INDÉSIRABLES .................................................................................................. 11
ABUS DU MÉDICAMENT, TOXICOMANIE ET DÉPENDANCE ................................ 14
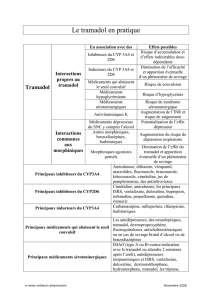
INTERACTIONS MÉDICAMENTEUSES ........................................................................ 15
POSOLOGIE ET ADMINISTRATION ............................................................................. 18
SURDOSAGE ..................................................................................................................... 20
MODE D’ACTION ET PHARMACOLOGIE CLINIQUE................................................ 21
ENTREPOSAGE ................................................................................................................. 25
DIRECTIVES PARTICULIÈRES DE MANIPULATION ................................................ 25
FORMES POSOLOGIQUES, COMPOSITION ET CONDITIONNEMENT ................... 25
PARTIE II : RENSEIGNEMENTS SCIENTIFIQUES ................................................................. 27
RENSEIGNEMENTS PHARMACEUTIQUES ................................................................. 27
ESSAIS CLINIQUES .......................................................................................................... 28
PHARMACOLOGIE DÉTAILLÉE .................................................................................... 30
TOXICOLOGIE .................................................................................................................. 31
RÉFÉRENCES .................................................................................................................... 32
PARTIE III : RENSEIGNEMENTS POUR LE CONSOMMATEUR ........................................ 34

DURELA®Monographie de produit (capsules de chlorhydrate de tramadol à libération prolongée) Page 3 of 36
Pr DURELA®
Capsules de chlorhydrate de tramadol à libération prolongée, 100, 200, 300 mg
PARTIE I : RENSEIGNEMENTS POUR LES PROFESSIONNELS DE LA
SANTÉ
RENSEIGNEMENTS SOMMAIRES SUR LE PRODUIT
Voie
d’administration Forme posologique /
Concentration Ingrédients non-médicinaux
orale Capsules à libération
prolongée
100, 200, 300 mg
Amidon de maïs, laque de calcium D et C
rouge nº 7 (E180), laque d’aluminium D et C
jaune nº 10, Eudragit NE 30D, laque
d'aluminium FD et C bleu nº 2 (E132),
gélatine, hypromellose, lactose monohydraté
200, stéarate de magnésium, cellulose
microcristalline, polysorbate 80, povidone
K30, propylène glycol, gomme laque,
émulsion simethicone, glycolate sodique
d'amidon, sucrose stéarate, talc et dioxyde de
titane.
INDICATIONS ET USAGE CLINIQUE
DURELA® (capsules de chlorhydrate de tramadol à libération prolongée) est prescrit pour :
• le soulagement de la douleur modérée à relativement sévère qui requiert un traitement
continu pendant quelques jours ou plus.
Gériatrie (> 65 ans) :
Les personnes en santé, âgées de 65 à 75 ans, à qui on administre une formulation à libération
immédiate de tramadol, ont des concentrations plasmatiques de tramadol et des demi-vies
d’élimination comparables à celles qui sont observées chez des personnes en santé de moins de
65 ans. DURELA® devrait être administré avec plus de prudence chez les patients âgés de
plus de 75 ans, en raison du risque accru d’effets indésirables dans cette population (voir
MISES EN GARDE ET PRÉCAUTIONS et POSOLOGIE ET ADMINISTRATION).
Pédiatrie (< 18 ans) :
L’innocuité et l’efficacité de DURELA®
n’ont pas été étudiées dans la population pédiatrique.
DURELA
®
n’est donc pas recommandé chez les patients de moins de 18 ans.

DURELA®Monographie de produit (capsules de chlorhydrate de tramadol à libération prolongée) Page 4 of 36
CONTRE-INDICATIONS
• Les patients qui ont une hypersensibilité au tramadol, aux opioïdes ou tout autre
ingrédient du produit ;
• Chez les patients ayant une obstruction gastro-intestinale mécanique connue ou
soupçonnée (occlusion intestinale, sténoses) ou des maladies/troubles pouvant affecter
le transit colique (iléus de tout genre) ;
• Toute situation où les opioïdes sont contre-indiqués, incluant l’intoxication aiguë avec
l’alcool, les hypnotiques, les analgésiques à action centrale ou les médicaments
psychotropes. Le tramadol peut aggraver la dépression du système nerveux central et la
dépression respiratoire chez ces patients ;
• Les patients qui prennent des inhibiteurs de la monoamine-oxydase (IMAO) (ou dans
les 14 jours suivant un tel traitement) ;
• Insuffisance rénale ou hépatique sévère (clairance de la créatinine inférieure à 30
ml/min et/ou classe C de Child-Pugh) ;
• Les patients ayant des douleurs mineures, intermittentes ou de courte durée qui peuvent
être traitées avec d’autres médicaments contre la douleur ;
• La gestion de la douleur péri-opérative ;
• les patients souffrant d’asthme aigu ou autre maladie pulmonaire obstructive et
asthmaticus de statut ;
• Les patients souffrant dépression respiratoire aiguë, de taux élevés de dioxyde de
carbone dans le sang et de cor pulmonale ;
• Les patients souffrant d’alcoolisme sévère, de delirium tremens et de troubles
convulsifs ;
• Les patients ayant une dépression du SNC sévère, une pression céphalo-rachidienne ou
intracrânienne accrue et des traumatismes à la tête ;
•
Les femmes enceintes, qui allaitent, ou lors du travail et de l’accouchement.
MISES EN GARDE ET PRÉCAUTIONS
Généralités
Les capsules de DURELA® devraient être avalées entières et ne devraient pas être brisées,
mâchées, dissoutes ou broyées puisque ceci peu provoquer la libération rapide et
l’absorption d’une dose excessive de tramadol, ce qui peut être fatal.
Risque de crises convulsives
Des crises convulsives ont été signalées chez des patients recevant du chlorhydrate de tramadol
à des doses comprises dans l’intervalle posologique recommandé. Les cas signalés
spontanément dans le cadre de la surveillance post-commercialisation indiquent que le risque de
crises convulsives est accru lorsque les doses de tramadol dépassent l’intervalle posologique
recommandé. L’usage concomitant de chlorhydrate de tramadol accroît le risque de crises
convulsives chez les patients prenant :
• Des inhibiteurs sélectifs du recaptage de la sérotonine (anti-dépresseurs ISRS ou
anorexigènes),

DURELA®Monographie de produit (capsules de chlorhydrate de tramadol à libération prolongée) Page 5 of 36
• Des antidépresseurs tricycliques (ATC) et autres composés tricycliques
(cyclobenzaprine, prométhazine, etc.),
• D’autres opioïdes.
L’administration de tramadol peut augmenter le risque de crises convulsives chez les patients
qui prennent :
• des inhibiteurs de la MAO (voir CONTRE-INDICATIONS),
• des neuroleptiques,
• d’autres médicaments qui abaissent le seuil convulsif.
Le risque de convulsions peut aussi augmenter chez les patients atteints d’épilepsie ou ayant des
antécédents de crises convulsives ou en présence d’un risque connu de crises convulsives (tel
qu’un traumatisme crânien, troubles métaboliques, sevrage d’alcool et de drogues, infections du
SNC). L’administration de naloxone en cas de surdosage de tramadol peut accroître le risque de
crises convulsives.
Réactions anaphylactoïdes
Des réactions anaphylactoïdes graves et rarement fatales ont été signalées chez des patients qui
étaient traités au tramadol. Lorsqu’elles se produisent, ces réactions ont tendance à survenir
après la première dose. On a également relevé d’autres réactions allergiques, tel que prurit,
urticaire, bronchospasme, angio-œdème, nécrolyse épidermique toxique et syndrome de
Stevens-Johnson. Les patients qui ont des antécédents de réactions anaphylactoïdes à la codéine
ou à d’autres opioïdes peuvent courir un risque accru et ne doivent donc pas prendre de
tramadol (voir CONTRE-INDICATIONS).
Abus du médicament, toxicomanie et dépendance
Le tramadol comporte un risque de dépendance psychique et physique de type morphinique
(μ-opioïde). Ce médicament a été associé à un état de manque, à des conduites toxicophiles et à
l’accoutumance. Des cas d’abus et de dépendance au tramadol ont été signalés. DURELA®
ne doit pas être utilisé chez les patients ayant une dépendance aux opioïdes. Le tramadol peut
faire réapparaître la dépendance physique chez certains patients qui ont déjà été dépendants à
d’autres opioïdes. La dépendance et l’abus, y compris les comportements toxicophiles et les
démarches illicites pour obtenir le médicament ne sont pas limités aux patients qui ont des
antécédents de dépendance aux opioïdes. Le traitement par DURELA® n’est pas
recommandé chez les patients qui ont tendance à abuser des médicaments ou qui ont des
antécédents de dépendance aux médicaments, ou qui font un usage chronique abusif d’opioïdes.
Une évaluation appropriée du patient, des pratiques de prescription adéquates, une réévaluation
périodique du traitement, ainsi qu’une exécution des ordonnances et une conservation adéquates
sont des mesures appropriées qui aident à limiter l’abus des opioïdes.
Un programme de gestion des risques a été établie afin de soutenir l’utilisation efficace et sans
danger de DURELA®. Les composantes considérées comme essentielles à ce programme de
gestion des risques sont les suivantes :
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
1
/
33
100%