Progression annuelle du programme de chimie

1/5
Progression annuelle du programme de chimie
Thème
Chapitre
Contenu
Objectifs
Activité /Supports
/Applications
Semaines
Cinétique
chimique
1- Courbe
cinétique
Vitesse de
formation et vitesse
de disparition d’un
corps.
Courbe cinétique.
Vitesse moyenne et
vitesse instantanée.
Définir la vitesse d’une
réaction.
Définir, à partir d’une courbe
cinétique, les vitesses moyenne,
instantanée et initiale de la
formation d’un produit ou de la
disparition d’un réactif.
Exercices :
Livre pages 45-46 n°1-2-4- 5-
6-7-8-9 et 10.
Projection :
ppt « vitesse de réaction ».
19 septembre
+
26 septembre
2- Facteurs
cinétiques
Facteurs cinétiques
Temps de demi-
réaction.
Identifier les facteurs
cinétiques.
Identifier le temps de demi-
réaction.
Exercices :
Livre pages 70 à 74 n°1-4-5-6-
8-10 et page 75 n°1.
Fiche d’exercice n°1 : La
cinétique chimique.
Projection :
ppt « facteurs cinétiques ».
3 octobre
+
10 octobre
+
17 octobre
3- Équilibre
chimique
Équilibre homogène
en phase liquide.
Constante KC.
Principe de Le
Chatelier.
Catalyse
Identifier et caractériser l’état
d’équilibre d’un système
réactionnel.
Reconnaitre les facteurs
affectant l’état d’un équilibre
chimique.
Appliquer le principe de Le
Chatelier.
Livre page 105 n° 2-4 et 5.
Fiche d’exercice n°2 :
Équilibre chimique
24 octobre
Collège de LA SAGESSE
Section Saint Jean
Brasilia - BAABDA
en
Département de chimie
Classe : SV SG
Année : 2016 - 2017

2/5
Chimie
organique
1- Les groupes
fonctionnels
Quelques familles
et groupement
fonctionnel.
Isomérie de
position et de
fonction.
Classer les composés
organiques en familles selon
leur groupe fonctionnel.
Identifier les groupes
fonctionnels.
Reconnaitre l’isomérie de
position et de fonction.
Acquérir la nomenclature des
groupes fonctionnels.
Exercices :
Livre page 203-204 n° 3-4-6 et
7
Fiche d’exercice n°3 : Analyse
élémentaire
31 octobre
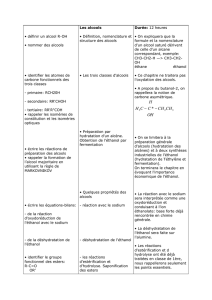
2- Les alcools
Fonction alcool et
nomenclature.
Quelques
réactions des
alcools.
Estérification-
montage
expérimental et
rôle.
Reconnaitre les alcools.
Acquérir la nomenclature
systématique des alcools.
Acquérir la notion d’isomérie
des alcools.
Reconnaitre la grande
réactivité des alcools.
Classer les alcools.
Exercices :
Livre page 226 à 228 n° 1-2-3-
4(sans a et f)-8-9-10-11 et 15.
Fiche d’exercice n°4 : Les
alcools.
7 novembre
+
14 novembre
+
28 novembre
3- Les aldéhydes
et les cétones.
Groupements
fonctionnels et
nomenclature.
Quelques réactions
des aldéhydes et
des cétones.
Tests
d’identifications
communs et
spécifiques.
Identifier les aldéhydes et les
cétones.
Acquérir la nomenclature
systématique des aldéhydes et
des cétones.
Acquérir la notion d’isomérie
des aldéhydes et des cétones.
Reconnaitre la grande
réactivité des aldéhydes et des
cétones.
Identifier expérimentalement
les aldéhydes, les cétones et la
classe d’un alcool.
Exercices :
Livre page 245 - 246 n°1-6-7-8
et 9
28 novembre
+
5 décembre
Examen 1 : 14 21 décembre

3/5
Chimie
organique
4- Les acides
carboxyliques
et leurs dérivés.
Groupement
fonctionnel et
nomenclature.
Dérivés d’acides.
Identifier les acides
carboxyliques et leurs dérivés.
Acquérir la nomenclature
systématique des acides
carboxyliques et leurs dérivés.
Identifier certaines réactions
chimiques des acides
carboxyliques et leurs dérivés.
Exercices :
Livre page 266 - 267 n°1-3 et
7.
9 janvier
+
16 janvier
Chimie
organique
(Classe
SV
SPECIAL
ITE)
SV :
cours en
classe
SG au
CDI :
Exercices
de session
5- Savons et
détergents
Obtention des
savons.
Identifier les matières premières
utilisées dans la fabrication des
savons.
Identifier la réaction de
saponification.
Décrire le mode d’action d’un
savon.
Citer les facteurs qui affectent
la solubilité d’un savon.
Exercices :
Livre page 337 – 339 n°1-2-4-
5 et 6.
23 janvier
6- Médicaments
courants
La synthèse de
l’aspirine et du
paracétamol
Définir un médicament.
Ecrire les équations de réactions
de synthèse de l’aspirine et du
paracétamol.
Citer les formulations de
l’aspirine et comparer leurs
effets secondaires.
Exercices :
Fiche d’exercice :
« Partie spécialité ».
30 janvier

4/5
Les
réactions
acide-base
en
solution
aqueuse
1- Acide fort/ Base
forte + Dosage
pH-métrique.
Définition et
mesure du pH.
Étude pH-métrique
de la réaction entre
un acide fort et une
base forte.
Identifier le point
d’équivalence.
Dosage acido-
basique par pH-
métrie.
Étude de la courbe
de dosage.
Définition et mesure du pH.
Étude pH-métrique de la
réaction entre un acide fort et
une base forte.
Identifier le point
d’équivalence.
Dosage acido-basique par pH-
métrie.
Étude de la courbe de dosage.
TP :
Réaliser un dosage pH-métrique
acido-basique d’un acide fort par
une base forte.
Projection :
ppt « Dosage».
Applications :
Livre page 132 à 135 n°1-2-4-
7-8-9-10-11-13-14-15-16-18-
19-20-21-22-23-24.
6 février
+
13 février
+
20 février
2- Acide faible-
Base faible +
Couple acide
base
Définition acide
faible- base faible-
couple acide-base
et constante
d’acidité.
Classification des
couples acide-
base.
Connaitre le concept acide-
base de Bronsted.
Identifier un acide faible et une
base faible.
Reconnaitre un couple
acide/base.
Connaitre les caractéristiques
d’un équilibre acido-basique.
Classer les couples acide/base.
Prévoir le sens d’une réaction
acido-basique.
Identifier une réaction acido-
basique quantitative.
Exercices :
Livre page 158 à 160 n°1 à 19.
27 février
6 mars
+
13 mars
3- Réaction entre
un acide faible
et une base forte
et inversement.
Dosage d’un acide
faible par une base
forte et inversement.
Étude de la courbe
de titrage.
Maitriser l’étude pH-métrique
de la réaction entre une
solution d’acide faible et une
solution de base forte.
Réaliser le dosage d’un acide
faible par pH-métrie.
Maitriser l’étude pH-métrique
de la réaction entre une
solution de base faible et une
TP :
Réaliser un dosage pH-
métrique acido-basique d’un
acide faible par une base forte.
Exercices :
Livre page 186 à 189 n°1 à 10.
20 mars
+
27 mars
+
3 avril

5/5
solution d’acide fort.
Réaliser le dosage d’une base
faible par pH-métrie.
Reconnaitre les solutions
tampons.
Examen 2 : 2428 avril
1
/
5
100%