Un exemple de variation génétique sans avantage sélectif : la

Un exemple de variation génétique sans avantage sélectif : la myoglobine.
La myoglobine est une protéine, présente chez tous les Vertébrés, dont la
fonction est de fixer le dioxygène dans les cellules des muscles.
L’étude de la molécule révèle la relation entre structure et fonction : la
chaîne polypeptidique forme, en un endroit, une "poche" dans laquelle un
groupement non protéique appelé "hème" comporte un atome de fer capable
de fixer 2 atomes d'oxygène.
Conséquence de cette relation structure-fonction : certaines parties de la
molécule doivent absolument demeurer invariable afin d'assurer une forme
convenable à la "poche" : ainsi chez toutes les espèces qui possèdent de la
myoglobine on retrouve systématiquement les même acides aminés en
position 94 (H=histidine), 44 (F=phénylalanine), 65 (H) et 69 (V=valine). En
effet, toute mutation au niveau du gène de l'hémoglobine qui conduirait à
un changement de l'un de ces acides aminés serait sans suite (l’allèle
présentant un très fort désavantage sélectif ne permettant pas le
développement de l’individu).
En revanche des versions différentes du gène peuvent apparaître, allèles
qui provoquent des modifications d'acides aminés non impliqués dans la
"poche" : ce sont des mutations sélectivement neutres, c'est à dire ne
présentant ni avantage, ni désavantage sélectif.
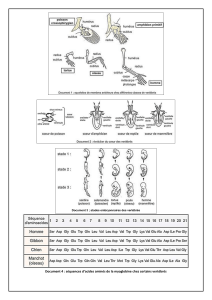
C'est ce que montre le tableau ci dessous obtenu à partir du logiciel Anagène : comparaison des séquences des
molécules de myoglobine aux positions 38-80 pour différents Vertébrés.
Question : Exploitez ce document afin de définir quels acides aminés sont indispensables à l’activité
moléculaire de l’hémoglobine.
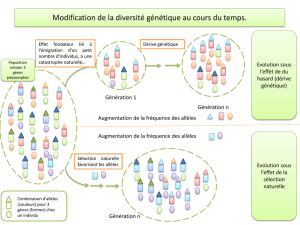
Rappel du cours : pour les allèles neutres (ni favorable ni défavorables, donc non soumis à la
sélection naturelle), leur fréquence au cours du temps (et des génération successives) évolue de
façon aléatoire : c’est la « dérive génétique », contrairement aux allèles ayant une valeurs
sélective : la fréquence des allèles favorables augmente, la fréquence des allèles défavorable
diminue.
1
/
1
100%