Métabolisme énergétique cellulaire du tissu cérébral

revue générale
Métabolisme énergétique cellulaire
du tissu cérébral : spécificités métaboliques
des tumeurs gliales
Cellular energetic metabolism of cerebral tissue:
metabolic characteristics of glial tumours
R. La Schiazza
1
F. Lamari
1
M.-J. Foglietti
2
B. Hainque
1,2
M. Bernard
1,2
J.-L. Beaudeux
1,2
1
Service de biochimie métabolique,
Hôpital de la Pitié Salpêtrière,
Assistance Publique Hôpitaux de Paris
2
Département de biochimie,
Faculté des sciences pharmaceutiques et
biologiques, Université Paris Descartes,
Paris
Article reçu le 20 juillet 2007,
accepté le 28 décembre 2007
Résumé.Cette revue rapporte les résultats obtenus sur divers modèles expéri-
mentaux concernant les spécificités physiologiques du métabolisme énergéti-
que cellulaire du tissu cérébral, permettant de mieux comprendre le métabo-
lisme énergétique des tumeurs gliales ainsi que les relations entre les
modifications métaboliques observées dans les gliomes et l’agressivité de ces
tumeurs. L’analyse de la littérature permet de constater que les caractéristiques
majeures du métabolisme tumoral sont sa relative indépendance vis-à-vis de
l’oxygénation et de l’apport de substrats énergétiques par voie vasculaire et la
coopération métabolique des cellules au sein d’une même tumeur. Cette auto-
nomie est rendue possible grâce à l’existence d’un effet Warburg, qui pourrait
être favorisé par des mutations génétiques qui ont été observées dans les
gliomes. Ces modifications métaboliques spécifiques peuvent ouvrir la voie à
de nouvelles approches thérapeutiques des gliomes.
Mots clés :métabolisme énergétique, tissu cérébral, gliomes, coopération
cellulaire, effet Warburg
Abstract.This review reports recent observations concerning specificities of
the cellular energy metabolism in cerebral tissues that highlight on characteris-
tics of that of glial tumours, such as the association of metabolic alterations
aggressiveness of these tumours. Compared to normal cerebral tissue, glial
tissue exhibits both a relative independence towards oxygen and substrate
furnitures and thus vascularization, as well as the metabolic co-operation of
neurons and glial cells within the tumour. Occurrence of a Warburg effect
could explain such metabolic autonomy that might be associated to genetic
changes observed in gliomas. Characteristics of the glycolytic metabolism
within glioma tissue therefore may be novel land therapeutic approaches for
the treatment of these tumours.
Key words:energetic metabolism, brain tissue, gliomas, cellular
co-operation, Warburg effect
Le cerveau humain est constitué d’environ 10
11
neurones
et environ dix fois plus de cellules gliales. Le réseau neu-
ronal, dont le rôle est la conduction des influx nerveux, est
soutenu par les cellules gliales qui assurent les échanges
entre les neurones, leur environnement et le sang à des fins
énergétiques, de synthèse et de recyclage moléculaires. La
névroglie est indispensable à la vie du neurone et à son
fonctionnement, ce qui explique son rôle essentiel dans la
pathologie nerveuse centrale et périphérique. La physiolo-
gie métabolique du cerveau et les interrelations métaboli-
ques entre glie et neurone ne sont aujourd’hui que partiel-
lement élucidées. Au début des années 1980, grâce au
Tirés à part : J.-L. Beaudeux
abc
Ann Biol Clin 2008 ; 66 (2) : 131-41
doi: 10.1684/abc.2008.0205
Ann Biol Clin, vol. 66, n° 2, mars-avril 2008 131
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 24/05/2017.

développement des techniques d’imagerie cérébrale,
notamment la tomodensitométrie par émission de posi-
trons (TEP), puis l’imagerie par résonance magnétique
(IRM), la spectroscopie par résonance magnétique (SRM)
et l’IRM fonctionnelle (RMf), les premières études du
métabolisme cérébral in vivo sur l’homme ont été possi-
bles, et cela de manière non invasive et éthiquement
acceptable. Dans les années 1990, l’amélioration des tech-
niques de culture in vitro et la réalisation du clonage
cellulaire ont permis de produire des modèles expérimen-
taux intéressants et donc un rapprochement par rapport
aux mécanismes cellulaires, génétiques et biochimiques
de l’état physiologique ou pathologique. L’objet de cette
revue est de faire le point des données actuelles sur le
métabolisme énergétique cérébral et ses dysfonctionne-
ments au cours de la tumorisation gliale.
Les substrats énergétiques du cerveau
Les réserves intracellulaires sous forme de glycogène sont
faibles et ne permettent pas le maintien prolongé de l’acti-
vité cérébrale, ce qui impose un apport de substrats éner-
gétiques via la circulation systémique. La barrière
hémato-encéphalique (BHE), formée par les cellules
endothéliales des capillaires cérébraux, constitue le site
principal d’échange entre le sang et le SNC.
Le glucose
Apport du glucose au tissu cérébral
Au repos, le cerveau qui ne représente que 2 % du poids
corporel consomme 25 % du glucose (environ 120 g/jour)
et 20 % de l’oxygène apportés par l’organisme. Le glu-
cose est transporté à travers la BHE par diffusion facilitée
en utilisant des transporteurs stéréo-sélectifs et bidirec-
tionnels, les GLUT. Au niveau cérébral, il existe plusieurs
isoformes de transporteurs GLUT. GLUT1 est un trans-
porteur ubiquitaire, très abondant dans les cellules endo-
théliales des microvaisseaux cérébraux. Les astrocytes,
dont les pseudopodes entourent la quasi-totalité de la
BHE, exprimeraient GLUT1, GLUT2 et GLUT4. GLUT3
est le principal transporteur des neurones, mais ces der-
niers expriment également GLUT4 et GLUT8 [1].
La régulation de l’accès du glucose au cerveau reste
encore hypothétique. Pour une glycémie normale
(~ 5 mM), le système de transport est saturé à moins de
40 %, alors que l’hexokinase (HK) est saturée à 95 % à la
concentration intracérébrale d’environ 1 mM [2]. L’affi-
nité de l’HK pour le glucose (Km = 40-65 lM) est plus
importante que l’affinité apparente du système de trans-
port. Ce serait donc l’activité de l’HK qui constituerait
l’étape limitante de l’accès du glucose au cerveau [1, 2].
Cependant, dans des conditions d’hypoglycémie sévère ou
lorsque la glycolyse excède la capacité de transport (sti-
mulation, anoxie, épilepsie, glycolyse tumorale...), le sys-
tème de transport peut devenir limitant [3]. Une redistribu-
tion des GLUT1 du cytosol vers la membrane ainsi qu’une
augmentation de la traduction des ARNm des GLUT inter-
viendraient dans la régulation à court terme du transport
du glucose à travers la BHE [3]. Lors d’une stimulation, il
existerait une activation du système de transport immé-
diate ou légèrement décalée par rapport au stimulus, selon
la structure cérébrale concernée [2].
Les capillaires cérébraux possèdent des récepteurs à
l’insuline particuliers, comportant une sous-unité aplus
petite. L’insuline n’a cependant pas d’effet sur le transport
du glucose à travers la BHE. Le métabolisme des cellules
gliales peut être modifié par l’insuline in vitro, mais son
rôle in vivo reste méconnu [3].
Réserves en glucose
La microscopie électronique a montré qu’il existe des
granules de glycogène surtout dans les astrocytes localisés
à proximité des régions synaptiques. Les neurones
contiennent également du glycogène au niveau du synap-
tosome, ainsi que tout l’équipement enzymatique néces-
saire à sa synthèse et à sa dégradation. Il existe un équili-
bre dynamique entre catabolisme et synthèse de glycogène
(19 mmol/kg/min), ce qui représente environ 2 % du flux
glycolytique cérébral. Ceci suggère que les réserves loca-
les en glycogène jouent un rôle important dans la fonction
cérébrale [4, 5]. Les propriétés cinétiques des enzymes
catalysant la synthèse et la dégradation du glycogène sem-
blent différentes des autres tissus et leur régulation est
contrôlée à un niveau local. Le métabolisme du glycogène
cérébral reste à l’abri des régulateurs systémiques, hormis
les corticostéroïdes circulants [5].
Le lactate
Au repos et dans les conditions physiologiques de lactaci-
démie, le passage du lactate à travers la BHE est négligea-
ble. En revanche, lors d’un exercice physique intense
induisant une augmentation du taux circulant de lactate le
passage du lactate à travers la BHE est anormalement
augmenté. Les caractéristiques cinétiques des transpor-
teurs des acides monocarbolyliques (MCT) permettent le
passage du lactate dans le cerveau dans les mêmes propor-
tions que le glucose [6].
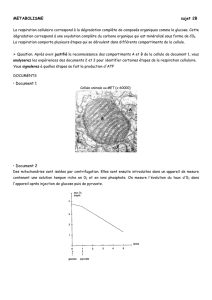
En se basant sur différentes observations expérimentales,
plusieurs équipes ont défendu l’hypothèse d’une produc-
tion de lactate généré et libéré par l’astrocyte, puis capturé
spécifiquement par les neurones via un transporteur de
type MCT (figure 1) [7-10]. Bouzier-Sore et al. [11], puis
Pellerin et Magistretti [12], ont également proposé que le
lactate astrocytaire serait le substrat préférentiel par rap-
port au glucose pour le neurone activé. Les besoins en
énergie du neurone activé se trouvent dans des proportions
revue générale
Ann Biol Clin, vol. 66, n° 2, mars-avril 2008132
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 24/05/2017.

95 : 5 respectivement, par rapport à l’astrocyte, alors que
le glucose ne respecte pas cette distribution. Leur hypo-
thèse est confortée par l’analyse de la distribution des
isoenzymes de la lactate déshydrogénase (LDH, E.C.
1.1.1.27) dans les différentes cellules du cerveau. Les
astrocytes sont enrichis en LDH5 tandis que les neurones
contiennent majoritairement la LDH1 [13], ce qui suggère
que le lactate astrocytaire serait converti en pyruvate dans
le neurone, puis oxydé dans la mitochondrie neuronale.
Cette hypothèse reste cependant controversée [14].
Les acides monocarboxyliques
En cas de carence en glucose, les corps cétoniques d’ori-
gine hépatique (b-hydroxybutyrate, acétoacétate) fran-
chissent la BHE par les MCT et peuvent être métabolisés
en acétyl-CoA dans la mitochondrie pour rejoindre le
cycle de Krebs. Ils permettent ainsi le maintien de la fonc-
tion neuronale en fournissant de l’adénosine triphosphate
(ATP) et protègent le cerveau de la protéolyse.
Les voies cataboliques du métabolisme
énergétique cérébral
Spécificités de la glycolyse cérébrale
La glycolyse est une étape métabolique qui se déroule
dans le cytoplasme et au contact de la membrane externe
des mitochondries. Le flux glycolytique est régulé par
trois enzymes régulatrices – l’hexokinase (HK, E.C.
2.7.1.1) la phosphofructokinase (PFK, E.C. 2.7.1.11) et la
pyruvate kinase (PK, EC 2.7.1.40) – en fonction de l’équi-
libre énergétique de la cellule. Les caractéristiques des
isoenzymes glycolytiques gliales favorisent des taux gly-
colytiques plus importants par rapport au neurone.
Au niveau du cerveau sain on retrouve essentiellement
l’isoenzyme HK I. Elle apparaît à la fois sous forme libre,
soluble dans le cytoplasme, et sous forme liée aux canaux
anioniques voltage-dépendants (VDAC) de la mitochon-
drie. Ces VDAC sont au contact des translocases des
nucléotides adénylés (ANT), qui permettent l’entrée de
l’adénosine diphosphate (ADP) et la sortie de l’ATP de la
A strocyteN eurone Glucose
Glucose
Pyruvate
Lactate
Lactate
Lactate
Acétyl-CoA
Glycolyse
2 ATP
Glycolyse
2 ATP
LDH 1 LDH 5
MCT2
Espace
intercellulaire
MCT1
MCT4
Glucose
Glycogène
Pyruvate
Acétyl-CoA
Glut
I
MCT2
Glut
I
MCT2
Cycle des
acides
tricarboxyliques
30 ATP
Cycle des
acides
tricarboxyliques
30 ATP
Figure 1. Représentation hypothétique des échanges métaboliques entre l’astrocyte et le neurone « astrocyte-neuron lactate shuttle ».
Dans cette hypothèse le lactate produit par l’astrocyte (riche en LDH5) est excrété dans l’espace intercellulaire grâce au transporteur
MCT1 ou il est capté par le neurone activé grâce au transporteur MCT2. Le lactate est transformé en pyruvate par le neurone riche en
LDH1 et utilisé comme substrat énergétique [12].
Métabolisme énergétique du tissu cérébral
Ann Biol Clin, vol. 66, n° 2, mars-avril 2008 133
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 24/05/2017.

mitochondrie, aux endroits où la membrane externe est
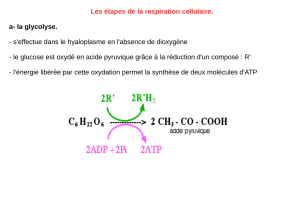
rapprochée de la membrane interne. L’HK s’organise en
tétramère au contact du complexe VDAC-ANT, qui est
stabilisé grâce à l’ADP (figure 2). L’HK ainsi fixée à la
mitochondrie est très peu sensible à la protéolyse cyto-
plasmique et présente donc une demi-vie allongée par rap-
port à la forme soluble [15]. Son inhibition par les pro-
duits de sa réaction, en particulier par le glucose
6-phosphate, est quasiment abolie. Le pH intracellulaire
(pHi) régule le degré de liaison : l’acidose favorise la
forme soluble et diminue de cette manière le flux glycoly-
tique [16].
L’activité de la PFK est stimulée par une chute de la
charge énergétique. Une baisse du pH, résultant d’une
surproduction de lactate, ralentit la glycolyse par inhibi-
tion de la PFK, ce qui évite l’acidose intracellulaire. La
glycolyse augmente seulement à partir du moment où les
modulateurs positifs de la PFK (ADP, adénosine mono-
phosphate (AMP), AMP cyclique et fructose 1,6-
bisphosphate) excèdent leurs concentrations critiques dans
le milieu [4]. Les neurones expriment essentiellement la
PFK1 alors que les astrocytes expriment également la
PFK2 et surtout l’isoenzyme PFK2.3, qui possède un rap-
port d’activité kinase/bisphosphatase le plus élevé [14,
17]. Cette isoenzyme astrocytaire favorise donc la syn-
thèse d’un des plus puissants activateurs de la PFK1 dans
l’astrocyte, le fructose 2,6-bisphosphate.
La synthèse du pyruvate cérébral est catalysée par la PK,
dont la forme M est largement majoritaire dans le cerveau
par rapport à la forme L (forme modulable par les
hormones). Elle est activée allostériquement par le fruc-
tose 1,6-bisphosphate et inhibée par l’ATP et l’alanine,
mais aussi par phosphorylation par la protéine kinase A
dépendante de l’AMP cyclique.
Devenir du pyruvate
La transformation du pyruvate en lactate est catalysée par
la LDH et s’accompagne de l’oxydation cytosolique du
NADH,H
+
. Dans les conditions physiologiques, 13 % du
pyruvate cérébral est transformé en lactate [18]. Dans des
conditions d’anaérobiose ou lorsque le rapport NADH,H
+
/
NAD
+
est élevé, quand la glycolyse excède l’utilisation
des métabolites par le cycle de Krebs, le pyruvate produit
est converti en lactate. Cette réaction permet de continuer
à faire fonctionner la glycolyse en permettant l’oxydation
du glycéraldéhyde 3-phosphate par le NAD
+
. Ceci est uni-
quement possible lorsque le lactate ne s’accumule pas,
étant donné son effet inhibiteur de la glycolyse.
La pyruvate déshydrogénase (PDH, EC 1.2.1.51) détermine
le flux du pyruvate vers la voie oxydative sous la dépen-
dance du potentiel rédox et de l’équilibre entre richesse et
besoin énergétiques. Au niveau cérébral, 50 % de l’enzyme
se trouve sous forme activée. Le pyruvate protège l’enzyme
de son inactivation par phosphorylation [4]
.
Particularités métaboliques des mitochondries
Les mitochondries du cerveau ont une affinité plus impor-
tante pour l’oxygène que les mitochondries hépatiques.
Elles se distinguent aussi de celles des autres tissus par
leur teneur plus élevée en enzymes non mitochondriales,
comme l’HK, la créatine kinase (CK, EC 2.7.3.2), et peut-
être la LDH. La CK est liée aux ANT du côté de l’espace
intermembranaire et l’HK du côté cytosolique [19].
L’HK et la CK fonctionnent pour maintenir des niveaux
d’ADP élevés à proximité de la mitochondrie en transfé-
rant un groupement phosphoryle à partir de l’ATP sur la
créatine ou le glucose, assurant ainsi la stimulation de
l’activité respiratoire. Les taux élevés de la respiration
mitochondriale à l’équilibre sont liés à la disponibilité
locale des substrats et au rapport ADP/ATP qui est élevé à
proximité de la mitochondrie, grâce à la formation des
complexes ANT-enzyme. Cette importante synthèse locale
de l’ADP n’est pas forcément reflétée par les dosages
effectués sur des homogénats de tissu cérébral, qui indi-
quent des rapports ATP/ADP globalement élevés [20].
Maintien de la charge énergétique cérébrale –
Rôle des astrocytes
La charge énergétique du cerveau à l’état physiologique
est globalement élevée mais variable en fonction de la
spécialisation métabolique de l’astrocyte, qui elle est liée
à la localisation anatomique, ainsi qu’au microenvironne-
ment au contact de la cellule. Les niveaux globalement
élevés d’ATP cérébral sont conservés lors d’une augmen-
F0F1 ATP
synthase
cytosol VDAC
ANT
CK
HK
PCr
ATP
ATP
ATP ADP
ADP
ADP
PCr
Figure 2. Organisation de l’hexokinase I (HK I) au contact de la
membrane mitochondriale : l’HK I est liée aux canaux anioniques
voltage dépendants mitochondriaux (VDAC), eux-mêmes au
contact des translocases des nucléotides adénylés (ANT). Le
complexe VDAC-ANT-HK I est stabilisé grâce à l’ADP et l’HK I se
trouve ainsi protégée de la protéolyse [18].
revue générale
Ann Biol Clin, vol. 66, n° 2, mars-avril 2008134
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 24/05/2017.

tation modérée de l’utilisation des réserves énergétiques
grâce aux réactions faisant intervenir l’adénylate kinase et
la CK-BB, qui sont en équilibre avec les réactions
cataboliques.
Les astrocytes sont considérés comme des cellules à fort
potentiel glycolytique et donc énergétique. En effet, il a
été observé que l’inhibition de la respiration mitochon-
driale stimule fortement la glycolyse dans les astrocytes,
mais pas dans les neurones. Ces derniers sont considérés
comme des cellules qui basent leur production d’énergie
essentiellement sur la phosphorylation oxydative [21].
Environ un tiers de l’ATP astrocytaire serait d’origine gly-
colytique. Les astrocytes seraient responsables d’au moins
15 % du métabolisme oxydatif du cerveau, soit 50 % de
celui des neurones [14].
Les tumeurs gliales
Les gliomes sont des tumeurs issues des différentes
lignées cellulaires de la névroglie épithéliale, de la macro-
glie et de l’oligodendroglie ou leurs précurseurs. Une
composante microgliale est souvent présente au sein des
gliomes, réalisant un infiltrat inflammatoire de la tumeur.
Les caractéristiques métaboliques des cellules tumorales
des gliomes dépendent entre autre de la structure cellulaire
et anatomique ainsi que du rôle des différentes cellules
gliales en physiologie.
Les tumeurs cérébrales représentent 5 % des cancers
humains [22] et constituent une source importante de mor-
bidité et de mortalité liée aux cancers. Le diagnostic de
tumeur cérébrale primaire est posé chez 11 à
12 pour 100 000 personnes par an, et on considère que
dans la population générale 1 enfant sur 1 300 dévelop-
pera une tumeur cérébrale primaire avant l’âge de 20 ans.
Les gliomes représentent 49 % des tumeurs primaires
cérébrales dont 15 % chez l’adulte et 25 % chez l’enfant
sont des gliomes de bas grade [23]. Les gliomes sont des
cancers différents des autres néoplasmes sous de nom-
breux aspects. La classification de l’OMS distingue quatre
grades de gliomes basés sur l’aspect histologique du tissu.
Les grades I et II correspondent au bas grade, les grades
III et IV correspondent aux gliomes de haut grade (glio-
mes malins). Le degré de malignité des gliomes est varia-
ble. Cependant, même les gliomes de bas grade restent
redoutables en raison de leur tendance fréquente à la trans-
formation maligne au cours du temps et de leur haut
potentiel d’infiltration. La moitié des gliomes de bas grade
subit une transformation maligne dans les 5 ans.
Données actuelles sur le métabolisme des gliomes
Comme dans les autres cancers, de profondes modifica-
tions du métabolisme énergétique ont été décrites dans les
gliomes [18]. La majorité des études actuellement
publiées concernent l’exploration in vivo, grâce aux diffé-
rentes méthodes d’imagerie médicale. Les travaux effec-
tués sur des cultures de différentes lignées de cellules de
gliomes, sur des xénogreffes de tumeurs ou des gliomes
induits chez l’animal ont permis de préciser certains
aspects spécifiques de la physiopathologie biochimique et
moléculaire de ces tumeurs. Ces travaux ont ouvert la
recherche sur de nouvelles cibles thérapeutiques avec le
souci de mieux prendre en charge les patients atteints de
cette pathologie tumorale complexe. Des mutations ont été
observées dans certains gliomes, en particulier la perte du
bras long du chromosome 10 [24], qui porte les loci de
certains gènes suppresseurs de tumeur, comme celui qui
code pour la protéine PTEN (phosphatase and tensin
homolog), une phosphatase, qui déphosphoryle le phos-
phatidylinositol 3,4,5-phosphate. La perte de fonction ou
l’absence de la protéine PTEN ainsi que cette activation
des récepteurs à activité tyrosine kinase (RTK) observées
dans un grand nombre de gliomes, induit une augmenta-
tion de l’activité de la phosphatidylinositol 3-kinase
(PI3K, EC 2.7.1.137) qui est responsable de l’activation
de Akt, qui joue un rôle important dans le développement
et la progression des gliomes, et du HIF-1 (hypoxia
inducible factor 1) [25-27]. La mutation de PTEN provo-
que également la perte de son contrôle inhibiteur sur
l’activité transcriptionnelle régulée par HIF-1 [25]. Par
ailleurs, la perte ou l’inactivation de la protéine p53, qui
est un événement précoce dans la genèse des gliomes [28],
stabilise la sous-unité HIF-1a[25]. Or, on sait aujourd’hui
que HIF-1 est responsable de l’augmentation de l’expres-
sion des gènes codant pour certaines enzymes de la glyco-
lyse comme la PFK, la phosphoglycérate kinase, l’aldo-
lase, l’énolase, l’isoenzyme PK-M, la LDH5, ainsi que
ceux codant pour les transporteurs du glucose GLUT1 et
GLUT3 [29-31]. La glycolyse ainsi stimulée permet de
maintenir des concentrations élevées en ATP et de résister
à l’hypoxie. Des anomalies de l’expression des transpor-
teurs membranaires du glucose ont également été rappor-
tées. Les gliomes humains expriment les ARNm de
GLUT1, mais sans expression de la protéine correspon-
dante. La présence de ces ARNm serait inversement corré-
lée à l’agressivité de ces tumeurs [32]. Bien que certains
auteurs aient décrit une augmentation de l’expression des
transporteurs GLUT1 dans les cellules bordant les régions
nécrotiques de gliomes de rats xénogreffés à partir de cellu-
les C6, ce serait l’hypoxie, par l’intermédiaire de HIF-1,
ainsi que l’acidose au niveau de ces régions, qui induit
l’augmentation du nombre de ces transporteurs [29]
.
Il a été rapporté que l’abondance des ARNm de GLUT3
était corrélée au grade de la tumeur. La glycoprotéine
GLUT3 a été mise en évidence dans les gliomes les plus
agressifs, les glioblastomes (GBM), mais pas dans les
Métabolisme énergétique du tissu cérébral
Ann Biol Clin, vol. 66, n° 2, mars-avril 2008 135
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 24/05/2017.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
1
/
11
100%