GTPase

BCM 2505 Signalisation cellulaire par GTPases – Mécanisme Page 1 / 10
Signalisation par activité enzymatique - GTPases
la transduction des signaux est un événement transitoire (de courte durée)
la signalisation par Ras et protéines G requière l'hydrolyse de GTP
o la réaction d’hydrolyse dépend de Mg2+ comme cofacteur; Mg2+
compense en partie les charges négatives portées par les phosphates
o la réaction est lente; si Ras et protéines G étaient des enzymes efficaces
i.e. possédant un taux d’hydrolyse élevée, les signaux transmis par ces
enzymes seraient trop courts pour être utilisables
par conséquent ces enzymes ont évolué de manière à avoir des
vitesses catalytiques peu élevées
la transduction et la durée de vie du signal dépendent de l'exploitation d'un état
conformationnel métastable provoqué par la liaison du GTP
la signalisation est terminée lorsque GTP est hydrolysé en GDP
Signalisation membranaire par les protéines G
les sous-unités Galpha sont en général des catalyseurs peu efficaces
l'hydrolyse du GTP par le sous-unité Galpha est lente (2 à 4 min-1)
la dissociation de GDP de la sous-unité α est encore plus lente (0.03 min-1)
o elle n'est pas détectable dans son complexe quaternaire en présence des
sous-unités βγ
leur taux d'hydrolyse est accéléré par des RGS afin de désactiver leur
signalisation.
o le taux d'hydrolyse du GTP augmente jusqu'à 100 min-1 dans ce cas
Signalisation cytoplasmique par Ras
l'hydrolyse du GTP est très lente (0.02 min-1)
les signaux sont désactivés par des GAPs afin d’accélérer la réaction
o le taux d'hydrolyse du GTP par Ras en présence de GAP est de l'ordre de
10 5 plus rapide et ce qui est presque identique à celui de Galpha en
présence de RGS

BCM 2505 Signalisation cellulaire par GTPases – Mécanisme Page 2 / 10
Transducine
la protéine Gt-alpha ou transducine est parmi les protéines Galpha les plus étudiées
au niveau structurel
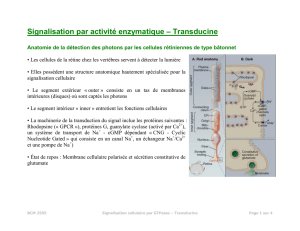
o Rappel ici : comment la transducine fonctionne comme médiateur de la
vision dans la rétine.
Bref, la transducine couple les signaux de la lumière captés par
le récepteur des photons, la rhodopsine, à l'effecteur la cGMP
dépendante phosphodiestérase (PDE)
L’essentiel dans ce schéma est la liaison du GTP et son hydrolyse impliquant
des changements conformationnels
la protéine Gt-alpha, montrée en figure 1a, possède deux domaines structuraux :
o Domaine hélicoïdal = GDI (chez Ras) – identifié en figure 1a
o Domaine GTPase = Ras – figure 1a et 1b
à noter : absence du domaine hélicoïdal (GDI) en Ras
Gt-alpha possède deux états conformationnels;
o Un état inactif liant GDP (montré dans la figure 1a et 2a en rouge; GDP
en jaune)
o Un état actif auquel GTP est lié (montré superposé dans la figure 2a; les
éléments de structure qui diffèrent par rapport à la liaison du GDP sont
colorés dans la figure 2a: en bleu pour des différences importantes et
désignées « switch » afin de les distinguées des différences moins
importantes en vert)
GDI
Gt-alpha
Ras
Domaine
GTPase
GDP
Figure 1a.
Figure 1b.

BCM 2505 Signalisation cellulaire par GTPases – Mécanisme Page 3 / 10
o les trois régions correspondantes aux différences conformationels
importantes, « switch » I, II, et III, sont identifiées en figure 2a;
l’agrandissement des régions « switch » I et II en figure 2b.
L’hydrolyse de GTP inactive l'effet stimulateur de Gt-alpha permettant au cycle
de signalisation de recommencer
Les changements conformationnels (« switch » I, II, III) sont donc impliqués
dans 1) l'échange de GDP avec GTP, stimulé par le GPCR activé, et 2) dans
l'hydrolyse du GTP
o la liaison de GTP au sous-unité α de l'hétérotrimère (rouge en figure 3a)
occasionne non seulement sa dissociation du Gt-alpha du récepteur, mais
produit également le déplacement des sous-unités βγ de l'hétérotrimère
(voir comment dans la comparaison par superposition de Gt- alpha-GTPS
avec Gt- alpha-GDP dans l'hétérotrimère en figure 3b)
Figure 3a.
Figure 3b.
II
III
I
Figure 2a.
Figure 2b.
Régions « Switch »
II
I
GTP (
P)
Galpha- GDP- Gbeta Ggamma
Région d’interaction
Perte d’interaction
GTP (
P)
N - terminus

BCM 2505 Signalisation cellulaire par GTPases – Mécanisme Page 4 / 10
Molécule
d’eau
Analogues
Réaction
non-
enzymatique
Des évidences cristallographiques des Galpha en présence de GTPγS, GDPNHP,
GDP, et GDP.AlF4- ont permis l'analyse du mécanisme d'hydrolyse
o l'hydrolyse non-enzymatique du GTP en GDP qui sera catalysé par
l’enzyme consiste en une attaque nucléophile en ligne sur le phosphate
o le GTPγS et GDPNHP sont des inhibiteurs compétitifs de la liaison par
GTP tandis que GDP.AlF4-, provoque une forme activée de protéine
Galpha et agit comme analogue de l'état de transition
à noter que GTPγS > 102 moins réactif que GTP; S - faible donneur d’électrons
Mécanisme d'hydrolyse enzymatique de GTP
L'hydrolyse du GTP en GDP par une attaque nucléophile en ligne directe par
une molécule d'eau sur le phosphate γ prévoit une catalyse enzymatique de type
base générale par un résidu capable d’accepter un proton d’une molécule d’eau
et ainsi générer un nucléophile hydroxyle
Les études cristallographiques ont en effet montré la présence d'une molécule
d'eau dans une position cohérente avec un tel mécanisme catalytique.
o dans la structure du complexe Gt-alpha.GTPγS, cette molécule d'eau est
positionnée afin d'interagir avec le S du thiophosphate et pourra faire une
attaque directe en ligne sur le phosphate γ
o dans la structure du complexe Gt-alpha.GDP.AlF4-, une molécule d'eau
fait partie de l'intermédiaire pentavalent
o il est donc probable que cette molécule d'eau joue le rôle d'un nucléophile
une fois activée
O
GDP
PO
OSHO
H
GTPS
O
F
Al
F
GDP FF
OH
H
GDP-AlF4-- H2O
O
O
P
GDP
O
O
OH
H
OO
P
GDP
O
O
O
H
H

BCM 2505 Signalisation cellulaire par GTPases – Mécanisme Page 5 / 10
Stabilisation
des charges
GTP est très stable en milieu aqueux parce qu’il est difficile de faire une attaque
nucléophile par OH-, qui est chargé négativement, sur le phosphate γ aussi
chargé négativement. De ce fait, une réduction dans les charges négatives
portées par les phosphates devrait se réaliser au sein du site actif afin de
stabiliser l’état de transition et d’accélérer la réaction
les études fonctionnelles dans la famille de protéines G ont démontré qu'Arg
174 (178 en Gi-alpha-1) joue un rôle essentiel dans l'hydrolyse du GTP
o des mutations de l'Arg 174 empêchent l'hydrolyse du GTP et
bloque Galpha dans son état toujours actif
o dans certaines tumeurs endocrines humaines, des mutants de R174
stimulent toujours l'adényl cyclase
o l'inhibition, par la toxine du choléra, de l'hydrolyse du GTP en GDP se
fait par l'entremise de la ribosylation de R174
le résidu R174 se retrouve dans la cavité du site actif proche de la région de
jonction (linkers) des deux domaines structuraux
dans la structure de Gt-alpha.GTPγS, l'Arg 174 joue un rôle critique à travers ses
ponts hydrogènes avec le sulfure du phosphate γ et possiblement avec l'oxygène
ester entre les phosphates β et γ
une pareille interaction de l'Arg 174 avec un fluor de AlF4- et l'oxygène ester
entre les phosphates β et γ est observée dans le complexe Gt-alpha.GDP.AlF4-
ce résidu est donc bien placé pour stabiliser la charge négative qui se développe
dans l'état transitionnel sur le phosphate γ pentacoordiné
NH
H
N
H
H
HN
Arg 174
O
GDP
P
O
OSHO
H
H
O
Thr 177
NGln 200
H
GtaGTPS
NH
H
N
H
H
HN
Arg 174
O
F
Al
F
GDP FF
OH
H
HO
N
HGln 200
O
Thr 177
GtaGDP-AlF4-- H2O
 6
6
 7
7
 8
8
 9
9
 10
10
1
/
10
100%