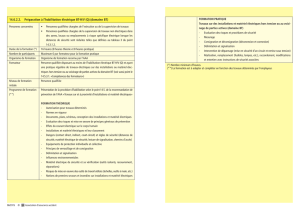
Anatomie de signalisation par transducine

BCM 2505 Signalisation cellulaire par GTPases – Transducine Page 1 sur 4
Signalisation par activité enzymatique – Transducine
Anatomie de la détection des photons par les cellules rétiniennes de type bâtonnet
• Les cellules de la rétine chez les vertèbres servent à détecter la lumière
• Elles possèdent une structure anatomique hautement spécialisée pour la
signalisation cellulaire
• Le segment extérieur « outer » consiste en un tas de membranes
intérieures (disques) où sont captés les photons
• Le segment intérieur « inner » entretient les fonctions cellulaires
• La machinerie de la transduction du signal inclue les protéines suivantes :
Rhodopsine (« GPCR »), protéines G, guanylate cyclase (activé par Ca2+),
un système de transport de Na+ - cGMP dépendant « CNG - Cyclic
Nucleotide Gated » qui consiste en un canal Na+, un échangeur Na+/Ca2+
et une pompe de Na+)
• État de repos : Membrane cellulaire polarisée et sécrétion constitutive de
glutamate
Gtαβ

BCM 2505 Signalisation cellulaire par GTPases – Transducine Page 2 sur 4
Détection de photons par les cellules de type bâtonnet : Activation de la signalisation
1) Interaction du photon avec le récepteur rhodopsine
2) L’association du complexe Gt-alpha-GDP (transducine) sous forme d'hétérotrimère au
récepteur photoactivé qui suscite
● l'échange de GDP en GTP du sous unité α provoquant
o la libération de la protéine G du récepteur
o le déplacement des sous unités βγ de l'hétérotrimère
3) Dans cette forme activée, le complexe Gt-alpha-GTP compétitionne pour les sous-unités
γ de la cGMP-PDE (αβγ2) (PDE = phosphodiestérase), formant le complexe Gt-alpha-GTP
– cGMP-PDE (γ2)
4) Les sous-unités αβ de la cGMP-PDE activée par ce fait décroît la concentration en
cGMP cytoplasmique
5) Provoquant ainsi la fermeture des canaux cationiques spécifiques et cGMP
dépendants (CNG)
6) L'hyperpolarisation de la cellule rétinienne (bâtonnent) est créée le long de la membrane et inhibe la sécrétion du
transmetteur glutamate à l’autre bout de la cellule

BCM 2505 Signalisation cellulaire par GTPases – Transducine Page 3 sur 4
Détection de photons par les cellules de type bâtonnet : Régulation
Comment les cellules de type bâtonnet sont-elles capables de détecter un seul photon ?
• Les récepteurs rhodopsine contiennent un chromophore 11-cis rétinal attaché de façon covalente (Ce
chromophore est extrêmement stable; isomérisation en trans < 1 molécule sur 4 x 1010 en absence d’un photon)
• Amplification des voies de signalisation due à l’empilement des disques
• Les disques contiennent des concentrations élevées en rhodopsine (représente jusqu’à 90% des protéines
membranaires; 45% de la masse membranaire des disques)
• Un seul photon transforme 11-cis rétinal en « all-trans » rétinal
• Ce changement du pigment rétinal provoque un changement conformationel en rhodopsine « Metarhodopsine II »
• L’état activé de rhodopsine est en mesure d’activer 1000 (ou plus) protéines G
• Les protéines G à leur tour activent un nombre similaire de PDE (phosphodiestérase)
• Les PDEs activées dégradent 50,000 molécules de cGMP en GMP, fermant ainsi une centaine de canaux CNG,
chacun de ceux-ci transportant > 10,000 ions

BCM 2505 Signalisation cellulaire par GTPases – Transducine Page 4 sur 4
Détection de photons par les cellules de type bâtonnet : Régulation
• Durée du signal ~ 2 secondes
Comment ces cellules sont-elles remises à leur état de repos ?
• Phosphorylation de la « Metarhodopsine II » par une rhodopsine kinase permettant la
liaison d’arrestine
• Une protéine régulatrice de signalisation de protéine G (RGS) interagit avec Gt-alpha et
augmente son activité GTPase
• Le changement en concentration [Ca2+] intracellulaire (dû à la fermeture du canaux CNG)
stimule la guanylate cyclase à synthétiser cGMP afin de restaurer le potentiel
membranaire de base
• Sécrétion du glutamate restituée
• Élimination de l’« all-trans » rétinal du récepteur
• L'hydrolyse de GTP GDP + Pi libère les sous-unités gamma attachées au complexe
Gt-alpha-GDP permettant ainsi la reconstitution de l'holoenzyme de cGMP-PDE (alpha-
beta-gamma2) et le Gt-alpha-beta-gamma-GDP hétérotrimère afin de recommencer le cycle de
signalisation
1
/
4
100%

![B] Mécanismes de réception de la lumière par l`œil](http://s1.studylibfr.com/store/data/004008122_1-c8e3db34fa5cf688fb3a4102ae80c9b0-300x300.png)