Sur les moments magnétiques de l`ion cuivrique

Sur les moments magn´etiques de l’ion cuivrique
Francis Birch
To cite this version:
Francis Birch. Sur les moments magn´etiques de l’ion cuivrique. J. Phys. Radium, 1928, 9 (4),
pp.137-141. <10.1051/jphysrad:0192800904013700>.<jpa-00205328>
HAL Id: jpa-00205328
https://hal.archives-ouvertes.fr/jpa-00205328
Submitted on 1 Jan 1928
HAL is a multi-disciplinary open access
archive for the deposit and dissemination of sci-
entific research documents, whether they are pub-
lished or not. The documents may come from
teaching and research institutions in France or
abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est
destin´ee au d´epˆot et `a la diffusion de documents
scientifiques de niveau recherche, publi´es ou non,
´emanant des ´etablissements d’enseignement et de
recherche fran¸cais ou ´etrangers, des laboratoires
publics ou priv´es.

SUR
LES
MOMENTS
MAGNÉTIQUES
DE
L’ION
CUIVRIQUE
par
M.
FRANCIS
BIRCH.
Faculté
des
Sciences
de
Strasbourg.
Sommaire. 2014
Jusqu’ici,
les
moments
atomiques
du
cuivre
divalent
ont
été
déterminés :
1.
Par
l’étude
des
sels
cuivriques
en
solution,
en
admettant
la
loi
de
Curie,
ce
qui
a
donné
toujours
des
nombres
fractionnaires
de
magnétons ;
2.
Par
une
seule
étude
thermo-
magnétique
des
sels
solides,
qui
a
donné
le
nombre
entier
de
10
magnétons,
avec
une
précision
médiocre.
Nous
avons
fait
l’étude
thermomagnétique
d’une
série
de
sels
cuivriques
(sels
anhydres,
hydrates,
solutions);
le
moment
dominant
est
de
10
magnétons
de
Weiss
avec
une
bonne
approximation;
un
état
à
9
magnétons
est
rencontré,
et
un
état
à
moment
plus
élevé
(11
magnétons)
est
probable.
Tous
les
sels
étudiés
suivent
la loi
de
Weiss, ~
(T -
03B8)
=
C,
sauf
CuO,
dont
le
paramagnétisme
est
très
peu
variable,
et
CuSO4
anhydre
aux
tempé-
ratures
élevées.
1.
Introduction.
-
Les
moments
atomiques
de
l’ion
Cu++
n’ont
été
déterminés
jusqu’à
présent
que
d’une
manière
très
incomplète.
En
général,
on
a
étudié
les
sels
cuivriques
en
solution
et
à
la
température
ordinaire;
en
admettant
la
loi
de
Curie,
on
a
pu
calculer
le
moment
atomique
au
moyen
de
la
formule
classique,
aat
=
V3RCat.
i
Liebknecht
et
Wills
(’)
ont
mesuré
avec
exactitude
les
coefficients
d’aimantation
de
plusieurs
sels
cuivriques
à
la
température
ordinaire
par
la
méthode
des
solutions
neutres.
Les
nombres
de
magnétons
(1)
qu’on
peut
déduire
de
leurs
mesures
sont
fractionnaires
et
voisins
de
9,6.
Les
expériences
de
Cabrera
et
Moles
(3)
sur
des
solutions
cuivriques
ont
donné
de
même
un
nombre
de
magnétons
fractionnaire
et
voisin
de
9,6;
mais,
ayant
remarqué
uno
légère
croissance
systématique
avec
la
dilution,
ils
ont
extrapolé
vers
la
dilution
infinie,
trouvant
ainsi
les
nombres
de
magnétons
9,Q0
et
9,93.
M"e
Jacobsohn
(*)
a
trouvé,
dans
des
solutions
contenant
de
1 î
pour
tOOjusqu’à
0,1
pour
100
de
cuivre,
un
coefficient
d’aimantation
sensiblement
indépendant
de
la
concentration,
et
un
moment
un
peu
supérieur
à
9,5
magnétons.
Enfin,
les
expériences
de
Cherbuliez
(~)
sur
le
nitrate
embrassent
un
grand
intervalle
de
concentrations,
entre
~2,~~
pour
100
de
et
0,0068
pour
100.
La
solution
la
plua
diluée
contient
un
nombre
d’ions
cuivriques
au
même
ordre
que
celui
du
nombre
des.
molécules
dans
un
gaz
à
la
pression
de
1/100
atmosphère.
Nous
avons
reproduit
une
courbe
(fig.
1)
établie
par
Cherbuliez,
qui
représente
non
seulement
ses
résultats
mais
aussi
ceux
de
Mlle
Jacobsohn
et
de
Cabrera
et
Moles.
-
On
voit
dans
cette
figure
que
Cherbuliez
a
retrouvé
la
croissanc3
de
l’aimantation
avec
la
dilution
qu’ont
observée
Cabrera
et
Moles
pour
d’assez
forLes
concentrations :
ensuite,
il
trouve
une
partie
qui
correspond à
la
constance
du
moment
signalée
par
Jacobsohn ;
puis
il
y
a
une
décroissance,
un
minimum
et
une
nouvelle
croissance
du
moment.
Une
extrapolation
vers
une
limite
à
10
magnétons
pour
la
concentration
nulle
n’est
pas
incompatible
avec
la
marche
de
la
courbe,
mais
elle
ne
s’impose
pas
d’une
manière
certaine.
( ~ ~
LlEBKxECHT
et
BVILLS,
dor
Ph yc.,
t.
’!
(1900),
p.
178.
(2)
Le
nombre
de
magnétons
de
Weiss
est
le
quotient
du
moment
atomique
tiré
de
la
foran
le
~It~
Langevin,
aat
=
par
le
magnéton
expérimental :
1
423,~
l’.E.11.
(3)
CADRERA
et
MOLE2,,
Trob.
del
Lab.
Inv.
(1914),
et
n·
83 (1919).
(4)
l’hfee
( 1916),
Zurich.
e)
CHERBUHEX,
Thèse
(1,91),
Zurich.
,
°
l0
Article published online by EDP Sciences and available at http://dx.doi.org/10.1051/jphysrad:0192800904013700

138
On
peut
chercher
la
raison
de
ces
phénomènes
compliqués
dans
la
tendance
bien
connue
du
cuivre
à
former
des
ions
complexes,
et
dans
les
équilibres
entre
divers
ions
porteurs
de
moments
différents.
Fig.
1.
-
Courbe
de
Cherbuliez.
Nombre
de
magnétons
en
fonction
de
la
conceutratioïL.
Mais
Cabrera
et
Dupéricr
(1)
et
Chatillon
(~)
ont
montré
que
les
solutions
paramagné-
tiques
obéissent,
dans
certains
cas,
à
la
loi
de
Weiss /.
( T -
6)
=
C,
avec
0
0,
la
valeur
de 8
étant
indépendante
de
la
concentration.
Il
est
donc
nécessaire,
pour
la
détermination
du
moment,
d’étudier
la
variation
thermique.
MUe
Jacobsohn,
il
est
vrai,
a
cru
établir
par
des
mesures
(g)
entre
0°
et
tJ0°
que
les
solutions
des
sels
cuivriques
obéissent
à
la
loi
de
Curie.
Nos
mesures
sur
le
chlorure
cuivrique
en
solution
donnent
au
contraire
des
points
de
Curie
très
nets.
D’ailleurs,
aucune
des
substances
étudiées
par
nous
ne
donne
un
point
de
Curie
s’écartant
du
zéro
absolu
de
moins
de
10°.
On
possède
une
étude
thermomagnétique
de
sels
de
cuivre
à
l’état
solide,
faite
par
Ishiwara
et
Honda
et
Ishiwara
(9).
Leurs
expériences
pour
le
sulfate
et
le
chlorure
anhydres
donnent
une
variation
approximativement
linéaire
dans
de
grands
intervalles.
Recalculées
par
P.
Weiss,
elles
ont
donné
les
nombres
portés
dans
le
tableau
I.
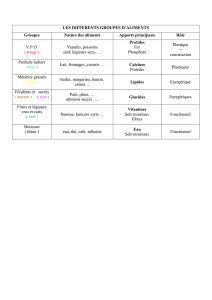
TABLEAU
1
(6)
CABREllB
et
DuPÉRtER,
J.
t.
6
(1925),
p.
12’.
(7)
Thèse,
Strasbourg
(1927)
et
Ann.
de
Phys.
(à
paraitre
en
1~28).
(s)
Ces
mesures
de
la
variation
thermique
semblaient
au
premier
abord
vérifier
la
loi
de
Curie ;
en
regardant
de
plus
près,
nous
avons
trouvé
qa’elles
suivent
avec
une
précision
beaucoup
plus
grande
la
loi
de
BVeiss, X
(T -
6)
=
C.
Des
six
séries
de
mesures,
il
y
en
a
trois
ou
6
= -
10°
avec
n
=
9,72
magnétons;
deux
autres
donnant
0
= -
5°
et 0
_ -
30°
avec n =
9,6
et
10,0
magnétons,
respecliycm8nt;
et
la
sixième,
pour
une
solution,
ammoniacale,
donne
8
=
+
10°
et ii
--
8,97.
Il
est
intéressant
de
comparer
cette
interprétation
avec
nos
résultats
donnés
plus
loin.
(~I)
I:5HIWARA,
Sc.
Rah.
Tôluku
t,
3
(i9li),
p,
303;
HoxDA
et
lamwARA,
t. 4
(1915),
p.
215.

139
Elles
semblent
donc
donner
le
nombre
entier
10
et,
en
outre,
une
indication
en
faveur
porteur
de
moment
moindre.
Cependant,
ces
déterminations
faites
à
l’aide
de
la
pente
moyenne
de
droites
ne
tiennent
pas
compte
de
certaines
irrégularités
que
présentent
les
observations:.
Les
expériences
que
nous
avons
faites
et
qui
sont
reproduites
plus
loin
montrent
que
quelques-
-unes
de
ces
irrégularités
n’ont
peut-être
pas
un
caractère
accidentel.
Les
nombres
ci-dessus
ne
doivent
donc
pas
être
acceptés
sans
réserves.
2.
Méthode
de
mesures. -
Nous
avons
fait
l’étude
thermomagnétique
d’une
série
"de
sels
cuivriques
(sels
anhydres,
hydrates,
solutions)
par
la
méthode
du
champ
non-
uniforme
avec
un
appareil
souvent
décrit (’°).
L’appareil
était
étalonné
avec
l’eau
ou
avec
le
pyrophosphate
de
manganèse;
les
valeurs
ainsi
trouvées
s’accordent
à
un
millième
près.
Les
températures
élevées
étaient
obtenues
au
moyen
d’un
petit
four
à
ruban
de
nichroille (11)
avec
circulation
d’eau;
pour
un
courant
donné,
la
température
s’équilibrait
au
bout
de
vingt
minutes
environ,
restant
constante
ensuite
et
uniforme
à
un
dixième
de
degré
près
dans
une
cloche
d’argent
qui
entourait
la
substance.
On
mesurait
la
température
avec
un
potentiomètre
et
un
thermocouple
fixé
à
cette
cloche,
étalonné
au
moyeu
d’un
couple
connu
-dont
la
soudure
chaude
était
placée
à
l’intérieur
de
la
cloche.
L’erreur
absolue
sur
la
température
de
la
substance
est
inférieure
à
un
demi-degré.
Pour
les
basses
températures,
eon
employait
un,
récipient
en
cuivre
contenant
un
mélange
réfrigérant
(neige
carbonique,
.air
liquide,
glace
fondante)
qui
entourait
la
substance,
et
l’on
mesurait
la
température
au
moyen
d’un
thermomctre
à
pentane.
Les
corps
étudiés
étaient
chauffés
dans
des
ampoules
.scellées,
ce
qui
retardait
la
décomposition
en
quelques
cas,
et
permettait
d’atteindre
des
températures
élevées
sans
perte
de
substance.
Les
sels
que
nous
avons
étudiés
étaient
ou
bien
des
sels
purs
cristallisés
Iiahlbaum
~~Zur
Analyse
mit
Garantieschein)
ou
bien
des
sels
provenant
de
l’Institut
Chimique
de
l’Université
de
Strasbourg,
recristallisés
plusieurs
fois.
Nous
avons
dosé
électrolytiquement
tes
solutions
et
les sels
hydratés.
’
Mais
il
importait
surtout
de
s’assurer
de
ce
qu’on
peut
appeler
la
pureté
physique
des
-substances.
On
ne
peut
obtenir
.de
résultat
ayant
une
signification
précise
que
si
tous
les
:IOns
cuivriques
possèdent
le
même
moment.
Les
expériences
de
Cherbuliez,
ce
que
l’on
1
-sait
par
ailleurs
des
ions
complexes
du
cuivre
en
solution
rendaient
cette
précaution
indispensable.
On
sait,
par
de
nombreux
exemples
fournis
par
d’autres
substances,
que
le
phénomène
simple
du
paramagnétisme
est
la
variation
linéaire
de
1,/Z
en
fonction
de
l’
--Nous
avons
considéré
cette
propriété
comme
le
critérium
de
la
présence
d’une
seule
espèce
~~de
porteur
de
moment.
En
effet,
on
voit
facilement
que
la
présence
en
proportions
variables
;de
porteurs
de
moments
différents
doit
altérer
la
loi
linéaire.
Cette
loi
est
donc
une
!,condition
nécessaire
de
la
pureté
physique;
mais
elle
n’est
pas
une
condition
suffisante.
Pour
chaque
série
de
mesures,
nous
avons
fait
les
produits
~~
(7°
-
0)
-
G’,
en
cherchant
la
valeur
de 6
pour
laquelle
ce
produit
reste
constant;
si
Z
est
le
coefficient
d’aimantation
latomique,
le
produit
est
la
constante
de
Cume
atomique
et
le
moment
atomique
se
déduit
de
la
formule
classique..
Il
y
a
lieu
de
corriger
le
coefficient
d’aimantation
moléculaire
(coefficient
d’aimantation
4xtassique
multiplié
par la
masse
moléculaire)
du
diamagnétisme
de
l’anion
et
en
outre,
du
.diamaânétisme
sous-jacent
du
cuivre
lui-même,
afin
d’avoir
le
coefficient
atomique.
Pour
les
anions,
nous
avons
utilisé
les
résultats
de
Pascal
e2)
qui
donnent
pour
la
valeur
-
33,(1
X
10~,
et
pour
Cl,
-
20,1 X
i0"~.
Le
diamagnétisme
sous-jacent
du
cuivre
n’est
,pas
connu
directement ;
nous
avons
pris
la
valeur
moyenne
des
diamagnétismes
des
éléments
-qui,
dans
le
système
périodique,
encadrent
ceux
de
la
famille
du
fer,
soit
-
18 X
10-6.
(io)
P.
BYEISS
et
(i.
J.
Phys.,
t.
5
(1911),
p.
1,
273,
11É
et
893;
(~.
et n.
J.
~.
7
(19.6),
Iie
6,
p.
180.
""
(~
1
FoËX
et
FORRHR,
loc.
cit.
(’2)
P.
PASCAL,
C.
/2.,
L 173
(i921),
p.
4 hh.
,

140
3.
Résultats
et
conclusions. -
Sous
avons
donc,
pour
le
calcul
des
moments,
laissé
délibérément
de
côté
les
expériences
dans
lesquelles -
=
T
est
représenté
par
une
P
X
r
Ît )
courbe.
Il
reste
alors
les
observations
dont
les
résultats
sont
consignés
dans
le
Tableau
II.
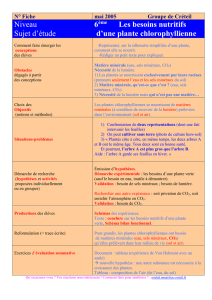
TABLEAU
II.
Nous
avions
enfin
étudié
CuO,
qui
présente
un
paramagnétisme
notable
mais
peu
variable,
comme
le
montre
le
Tableau
III.
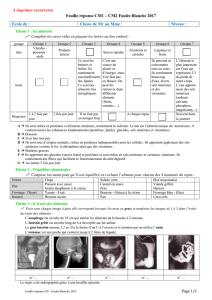
TABLEAU
111.
Nous
n’avons
pas
fait
ici
la
correction
du
diamagnétisme
de
Paterne
d’oxygène
qui
est
t
probablement
de
l’ordre
de -- 5
X
On
voit,
d’après
le
Tableau
II,
que
le
moment
de
10
magnétons
a
été
obtenu
6
fois,
une
fois
dans
la
solution
de
CuCl2,
une
fois
dans
l’hydrate
CuCI,211,0,
une
fois
daiis
deux
fois
dans
CuSO,,11,0
et
dans
CuSOf
anhydre.
On
a
trouvé
pour
CuC12
en
solution,
dans
un
autre
intervalle
de
température,
un
deuxième
état
de
9,Ci
magnétons.
Les
huit
déterminations
du
moment
du
CuCl2
anhydre
se
répartissent
en
un
groupe
compact
de
cinq
mesures
très
voisines
de
leur
moyenne
9,60;
une
mesure
aberrante
à
9.11
et
deux
à
9,76.
Nous
n’avons
pas
le
moyen
de
décider
s’il
s’agit
réellement
d’un
moment
à
9,6
magnétons
ou
de
moments
moyens
provenant
de
la
présence
simultanée
de
porteurs
de
moments
différents.
Cependant,
l’existence
des
moments
aberrants
est
plutôt
favorable
à
cette
dernière
interprétation.
Outre
l’oxyde
cuivrique,
la
seule
substance
pour
laquelle
nous
ayons
trouvé
une
variation
non
linéaire
est
le
sulfate
anhydre
entre
900°
et
~00~
qui,
d’après
les
physiciens
 6
6
1
/
6
100%