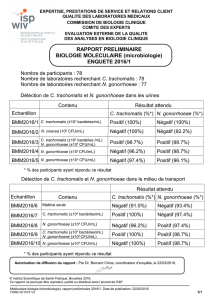
Diagnostic Chlamydia trachomatis: Méthodes et Perspectives

DOSSIER
21
La Lettre du Gynécologue - n° 246 - novembre 1999
a nomenclature des actes de biologie présentée au
Journal officiel du 12 août 1997 intègre les méthodes
de biologie moléculaire, en particulier l’amplification
génique, dans les tests utilisables pour le diagnostic d’infec-
tions à Chlamydia trachomatis. Cette mesure très attendue per-
met désormais d’améliorer la sensibilité du diagnostic
jusqu’alors difficile de ces infections souvent pauci-bacté-
riennes, caractérisées par un parasitisme intracellulaire strict
(1). Ce sont des infections sexuellement transmissibles (MST)
majeures (2), qui touchent surtout l’appareil urogénital, mais
peuvent aussi atteindre les yeux, le péritoine, les articulations.
Elles atteignent majoritairement la population adulte, mais la
transmission de la mère au nouveau-né est possible, avec
induction de conjonctivites et de pneumopathies chez celui-ci.
Nous ne discuterons pas du diagnostic biologique de la lym-
phogranulomatose vénérienne, ou maladie de Nicolas et Favre,
due à des souches particulières de C. trachomatis (sérotype L)
extrêmement rares en France.
Le but de cet article est de recenser les différents tests biolo-
giques disponibles aujourd’hui en France et de déterminer leur
meilleure utilisation dans chaque situation clinique d’infection
à C. trachomatis tout en respectant les nouvelles règles de
nomenclature.
LE DIAGNOSTIC BIOLOGIQUE DES INFECTIONS
ÀC. TRACHOMATIS
Le diagnostic biologique d’une infection à C. trachomatis a
toujours été difficile pour plusieurs raisons. Certains tests utili-
sés manquent de sensibilité (tests directs immunoenzyma-
tiques, tests sérologiques alors que l’infection est localisée aux
muqueuses), d’autres manquent de spécificité (certains tests
d’immunofluorescence directe, sérologies) ou sont difficiles à
réaliser (culture cellulaire). De plus, les techniques de prélève-
ment employées (prélèvement urétral ou d’endocol) sont sou-
vent mal acceptées par les patients. Enfin, les prescriptions
concernant ces actes de biologie sont parfois mal adaptées. À
ce titre, il faut rappeler que lorsqu’une recherche de C. tracho-
matis est indiquée, la prescription doit être explicite et spéci-
fier la recherche de cette bactérie et le site de prélèvement. Cet
acte ne peut être remboursé que s’il est demandé par le pres-
cripteur, sauf chez la femme où la recherche sur prélèvement
de l’endocol et de l’urètre peut être réalisée à l’initiative du
biologiste sur arguments symptomatologiques ou épidémiolo-
giques (moins de 25 ans, et/ou partenaires multiples, et/ou
autre MST diagnostiquée…), mais uniquement en utilisant un
test immunoenzymatique, d’immunofluorescence ou d’hybri-
dation moléculaire.
Amplification de la bactérie sous forme réplicative par culture
L’isolement de la bactérie sur culture cellulaire est une
méthode de diagnostic sensible et très spécifique, encore
considérée comme méthode de référence, notamment dans le
cas d’expertises médico-légales. Le principal inconvénient est
l’absolue nécessité d’une procédure de transport et de conser-
vation des prélèvements parfaite du fait de la fragilité de la
bactérie. Le maximum de sensibilité de la culture est obtenu
sur écouvillonnage d’endocol et/ou d’urètre placé dans un
milieu de transport approprié de type saccharose-phosphate
(2SP), qui se conserve à -20 °C avant utilisation puis à 4 °C
après inoculation, et doit être ensemencé dans les heures qui
suivent sur culture cellulaire. Cette technique est peu appro-
priée à la recherche de la bactérie dans certaines situations
(prélèvement de sperme, patient sous antibiothérapie, quel que
soit l’antibiotique utilisé, patiente ayant effectué une toilette
vaginale récente ou ayant utilisé un traitement local, patiente
présentant une mycose…). La recherche de C. trachomatis par
culture cellulaire est également très peu sensible sur prélève-
ments profonds (sperme, biopsies, liquides de ponction…) et
prélèvements de premier jet d’urine.
Mise en évidence des antigènes chlamydiens
Les trousses de diagnostic permettant la mise en évidence
directe des antigènes de C. trachomatis sont très employées du
fait de leur simplicité d’utilisation. Il s’agit des tests immu-
noenzymatiques (EIA) ou des tests d’immunofluorescence
Diagnostic biologique des infections
à Chlamydia trachomatis : données pratiques actuelles
et perspectives en santé publique
!A. Bianchi*, A. Ebel*, G. Cessot*
* Institut Alfred-Fournier, 25, boulevard Saint-Jacques, 75680 Paris Cedex 14.
L

directe (IFD). Ces méthodes sont le plus souvent adaptées à la
recherche des Chlamydiae sur prélèvement d’endocol et
d’urètre et nécessitent d’utiliser un milieu de transport propre à
chaque trousse, sauf pour l’IFD, seul test permettant un
contrôle de la bonne qualité du prélèvement, car il se fait sur
un frottis cellulaire sur lame. Ces réactions mettent en évi-
dence les antigènes communs aux diverses espèces de Chlamy-
diae (lipopolysaccharide de paroi LPS) ou bien, plus rarement,
des antigènes spécifiques de l’espèce trachomatis (antigène de
la membrane externe de la bactérie, PMME ou MOMP).
L’IFD et certains tests EIA rapides (type savonnette) permet-
tent d’effectuer l’analyse en quelques minutes. Le défaut de
ces méthodes est souvent un manque de sensibilité, pouvant se
traduire par un résultat faussement négatif lorsque le prélève-
ment contient peu de bactéries pour ce qui est des tests EIA
(3), et une grande subjectivité de la lecture, nécessitant un bio-
logiste entraîné pour ce qui est des IFD (4).
Mise en évidence du génome de C. trachomatis par hybrida-
tion moléculaire
La recherche de C. trachomatis peut se faire par simple hybri-
dation moléculaire sans amplification génique. Il peut s’agir
d’hybridation ADN-ADN ou ARN-ADN. Ces méthodes ont
une sensibilité bien moindre que les techniques d’amplifica-
tion, qui serait plutôt proche de celle de certains tests EIA. Il
existe une trousse utilisant l’hybridation entre l’ARNr de
C. trachomatis et une sonde à ADN (Gen-Probe/bioMérieux).
La recherche directe des acides nucléiques de la bactérie par
amplification génique
Le biologiste dispose maintenant de méthodes de diagnostic
direct pour la recherche du génome bactérien par amplification
génique, qui associent une grande sensibilité (stabilité des
acides nucléiques dans le prélèvement, détection d’un très petit
nombre de bactéries, utilisation d’un contrôle interne détectant
la présence d’inhibiteurs dans le prélèvement), une excellente
spécificité (amplification incluant un système anti-contamina-
tion), une bonne faisabilité et une bonne reproductibilité des
résultats (méthodologies simples comparables à celle des tests
ELISA, automatisation possible) (3-5).
De plus, la modification des techniques de prélèvement devrait
considérablement améliorer l’acceptabilité d’une telle
recherche par le patient, cette recherche pouvant être effectuée
sur le premier jet urinaire chez l’homme et la femme, voire sur
un simple prélèvement des sécrétions génitales par écouvillon-
nage vulvaire (6). L’amplification génique est aussi la méthode
recommandée pour la recherche de Chlamydiae dans le
sperme, au niveau des conjonctives, de prélèvements profonds
(ponction de liquides, biopsies…). En revanche, la nomencla-
ture ne prévoit pas le remboursement de tests d’amplification
génique pratiqués sur prélèvement d’endocol ou d’urètre.
Quatre trousses d’amplification génique sont actuellement dis-
ponibles et enregistrées à l’Agence du Médicament. Trois
amplifient un fragment du plasmide cryptique de C. trachoma-
tis, l’une par LCR ou Ligase Chain Reaction (Abbott), les
deux autres par PCR ou Polymerase Chain Reaction (Roche
Diagnostic Systems) ; la quatrième amplifie un fragment
d’ARN ribosomal (ARNr) de C. trachomatis par Translated
Mediated Amplification (TMA-GenProbe/bioMérieux).
Le sérodiagnostic
Le sérodiagnostic occupe une place limitée dans la recherche
d’une infection à Chlamydiae (4, 7).
Trois difficultés majeures se posent :
– l’existence de réactions croisées entre les différentes espèces
de Chlamydiae,
– une réponse humorale très variable d’un individu à l’autre,
peu corrélée à l’existence d’une pathologie active,
– l’absence de méthodologie standardisée de détection des
anticorps.
La structure antigénique complexe de la bactérie fait que les
techniques, réaction de fixation du complément (RFC), immu-
nofluorescence indirecte (IFI) ou EIA, basées sur la recherche
d’anticorps dirigés contre le LPS (antigène commun aux diffé-
rentes espèces de Chlamydiae et à d’autres bacilles à Gram
négatif), ne peuvent différencier les anticorps contre C. tracho-
matis, C. pneumoniae et C. psittaci (8). L’existence de réac-
tions croisées très importantes entre ces espèces a fait suresti-
mer dans de nombreuses enquêtes épidémiologiques la
séroprévalence des infections à C. trachomatis (9). Seule la
comparaison des taux d’anticorps respectifs de chaque espèce
par technique de micro-immunofluorescence (10) permet
d’évoquer un diagnostic étiologique.
Il n’existe pas encore de test spécifique pour chaque espèce,
mais certaines trousses ELISA utilisant des antigènes recombi-
nants de la protéine MOMP spécifique d’espèce sont en cours
d’évaluation (11). Lorsqu’une sérologie Chlamydiae est
demandée, la prescription doit donc préciser une recherche
simultanée vis-à-vis des deux espèces.
En fait, une réponse sérologique significative ne peut être mise
en évidence qu’en cas d’infection profonde, diffuse, alors
même que la recherche directe de la bactérie sur endocol ou
urètre peut s’avérer difficile à ce stade d’infection disséminée.
La découverte isolée d’un titre élevé en IgG ne suffit pas à
affirmer une infection évolutive, certains sujets gardant des
IgG à forts titres longtemps après une infection efficacement
traitée.
La présence d’IgM témoigne généralement d’une infection
récente ou évolutive, alors que la signification d’une présence
d’IgA reste discutée (persistance d’IgA plusieurs mois après
traitement). La recherche d’IgM spécifiques garde toute sa
valeur dans le diagnostic des infections à C. trachomatis chez
le nourrisson et le diagnostic des lymphogranulomatoses véné-
riennes chez l’adulte (4, 12).
Le sérodiagnostic des infections à Chlamydiae peut permettre
“d’alerter” dans le cas des infections disséminées (pneumopa-
thie à C. pneumoniae, lymphogranulomatose vénérienne, sal-
pingite à C. trachomatis), où des titres élevés en IgG associés à
la présence d’IgM sont évocateurs d’une infection active.
À l’avenir, l’étude de la réponse immunitaire cellulaire [recon-
naissance de lymphocytes spécifiques activés excrétant des
anticorps (Elispot), étude de la sécrétion de cytokines inflam-
DOSSIER
22
La Lettre du Gynécologue - n° 246 - novembre 1999

matoires…] permettra sans doute un diagnostic immunolo-
gique spécifique et précoce des infections à C. trachomatis.
Le biologiste doit rechercher deux des trois classes d’anticorps
(IgG, IgA, IgM) ; il pratiquera toujours une recherche d’IgG et
fera soit une recherche d’IgM (témoignant d’une infection
aiguë ou récente), soit une recherche d’IgA (de signification
intermédiaire entre la présence d’IgG et celle d’IgM). Le
médecin prescripteur peut préciser la classe d’immunoglobu-
line qu’il désire rechercher. La détermination d’un titre faible,
moyen ou fort est fonction de la méthode utilisée pour réaliser
le sérodiagnostic.
PRÉLÈVEMENTS
Quelles que soient la situation clinique et la méthode de
recherche de la bactérie, la qualité du prélèvement et sa
conservation sont essentielles à la bonne sensibilité du dia-
gnostic. Lorsqu’il s’agit d’un prélèvement des épithéliums
muqueux (urètre, endocol, conjonctive), un écouvillonnage
franc doit permettre de ramener des cellules. On utilisera de
préférence un écouvillon plastique à extrémité sécable en
forme d’olive (de type Bactopick) ou une petite brosse (type
cytobrush). Ces écouvillons seront placés ou déchargés dans
les milieux de transport propres à chaque méthode de détec-
tion. Pour les conjonctives, il est plus pratique d’utiliser un
écouvillon de coton qui sera déchargé dans le milieu de trans-
port.
La recherche de la bactérie sur urine se fait sur prélèvement de
10 à 15 ml du premier jet recueilli dans un flacon stérile. Il
faut impérativement demander au patient de ne pas uriner pen-
dant au moins une heure avant le prélèvement. Il est probable
que la sensibilité de la méthode puisse être légèrement aug-
mentée par le recueil d’un premier jet d’urine du matin, mais
cela n’est pas démontré. La présence de Chlamydiae dans les
urines, chez la femme, s’explique le plus souvent par une
contamination des urines par les sécrétions vaginales. Chez la
femme, un prélèvement des sécrétions génitales par écou-
villonnage vulvaire déchargé dans le milieu de transport
propre à la méthode d’amplification génique peut être utilisé.
Ce geste de réalisation facile a démontré son intérêt comme
autoprélèvement dans quelques études (6, 13).
Le sperme, les liquides de ponction et les fragments biopsiques
doivent être placés dans un flacon stérile. Les fragments biop-
siques, surtout s’ils sont petits, doivent être transportés dans un
milieu de transport approprié à chaque méthode, afin d’éviter
une dessiccation.
Seuls certains milieux de transport spécifiques destinés à la
recherche du génome de la bactérie peuvent se conserver pen-
dant quelques heures à température ambiante. Tous les autres
prélèvements doivent se conserver à +4 °C pour une durée
maximale de quelques heures avant l’inoculation sur culture
cellulaire, ou de quelques jours avant la recherche d’antigène
ou d’acide nucléique. Pour l’isolement sur culture, il est
conseillé de congeler le prélèvement à -80 °C plutôt que de le
conserver plus de 24 heures avant l’inoculation. Toutefois, la
congélation fait diminuer le titre infectieux du prélèvement.
SITUATIONS CLINIQUES ET MÉTHODES DIAGNOSTIQUES
APPROPRIÉES
L’infection urogénitale basse
Les infections à C. trachomatis représentent la première cause
de maladies sexuellement transmissibles d’origine bactérienne
(2). L’infection se localise au niveau des muqueuses épithé-
liales de l’endocol et de l’urètre, et peut persister de façon tota-
lement asymptomatique. Chez la femme, il n’existe aucun
signe spécifique, et même la normalité de l’examen au spécu-
lum ne doit pas faire éliminer le diagnostic, la cervicite n’étant
pas systématique (14). L’infection peut, à bas bruit, atteindre
les voies génitales hautes et provoquer des lésions tissulaires
irréversibles au niveau des trompes, responsables de stérilité
tubaire et de grossesse extra-utérine (GEU). Toute symptoma-
tologie urogénitale basse doit faire pratiquer une recherche de
C. trachomatis, en se méfiant en particulier des diagnostics
parfois abusifs de “mycose” ou “d’infection urinaire” sans
preuve microbiologique.
Chez l’homme, l’infection peut se manifester par une urétrite,
le plus souvent subaiguë, parfois limitée à la simple sensation
de gêne ou de picotements endo-urétraux sans écoulement
visible. L’extrême fréquence des formes totalement asympto-
matiques, en particulier chez le sujet jeune, chez qui la préva-
lence de l’infection est la plus élevée, pouvant aller jusqu’à
30 % (15, 16), devrait conduire à envisager un dépistage systé-
matique dans la population des moins de 30 ans. Ce dépistage
pourrait avoir lieu dans diverses circonstances telles que la
prescription d’un bilan de pilule contraceptive chez la jeune
femme, la réalisation d’un frottis de dépistage, lors d’une
demande de sérologie VIH (17), et bien sûr dans le cadre des
bilans d’interruption volontaire de grossesse, de GEU, prénup-
tiaux, ou au cours de la grossesse.
La recherche de C. trachomatis par amplification génique sur
premier jet d’urine est l’examen le plus simple à réaliser, bien
accepté par le patient, ayant une bonne sensibilité et une bonne
spécificité. C’est donc l’examen de choix chez l’homme et
chez la femme lorsque l’on désire faire uniquement un dépis-
tage de l’infection à C. trachomatis, dans un souci de faisabi-
lité et d’acceptabilité.
Cependant, chez la femme, la recherche de C. trachomatis sur
le premier jet d’urine paraît moins sensible que celle réalisée
sur un prélèvement d’endocol (12, 18). Si la recherche de
C. trachomatis s’intègre dans un bilan bactériologique plus
complet, il faut prescrire un prélèvement cervico-vaginal avec
recherche explicite de C. trachomatis sur l’endocol et l’urètre ;
la recherche couplée du germe sur ces deux sites améliore la
sensibilité diagnostique. La patiente devra éviter toute toilette
vaginale 24 heures avant le prélèvement. La recherche par
amplification génique n’étant pas reconnue par la nomencla-
ture pour l’endocol et l’urètre, la technique utilisée sera soit la
culture cellulaire, s’il s’agit d’un laboratoire pouvant effectuer
rapidement et quotidiennement l’isolement sur culture cellu-
laire, soit des méthodes de sensibilité moindre, l’hybridation
moléculaire ou la recherche d’antigènes par une technique
23
La Lettre du Gynécologue - n° 246 - novembre 1999

EIA. Le biologiste peut toutefois, à ses frais, pratiquer une
amplification génique afin d’améliorer la sensibilité de son test
dans un souci de qualité, indépendamment de la nomenclature.
Chez l’homme, la recherche sur premier jet d’urine est tout
aussi sensible que celle sur prélèvement urétral (19-21). Si l’on
désire faire un bilan bactériologique plus complet, en particu-
lier une recherche des autres germes responsables de MST, on
peut réaliser ce bilan sur le premier jet d’urine en même temps
que la recherche de C. trachomatis. Ce mode de prélèvement a
l’avantage d’une très bonne acceptabilité, mais reste cependant
moins sensible que le prélèvement urétral, notamment pour la
recherche du gonocoque. En cas de suspicion de gonococcie,
le prélèvement urétral doit donc être préféré au premier jet
d’urine. Une recherche couplée de C. trachomatis et de Neisse-
ria gonorroheae est possible, et très utilisée aux États-Unis ;
elle présente, dans le cas de suspicion d’infection à gonocoque,
l’intérêt de pratiquer la double recherche sur un même prélève-
ment (22). La recherche de C. trachomatis sur le premier jet
d’urine se fera par amplification génique, la culture étant
impossible sur ce prélèvement et les antigènes et acides
nucléiques étant sous forme trop diluée pour espérer une détec-
tion directe ; s’il s’agit d’un prélèvement urétral, cette
recherche se fera de préférence par culture cellulaire, par
hybridation moléculaire, ou encore par recherche d’antigènes,
avec les mêmes remarques qu’en ce qui concerne les prélève-
ments chez la femme.
L’infection génitale haute
C’est la conséquence d’une infection basse méconnue ou
insuffisamment traitée. Les principales complications en sont
la stérilité et la GEU. Ainsi, plus d’un tiers des femmes ayant
une infection urogénitale à C. trachomatis non ou mal traitée
vont développer une infection pelvienne. Le risque de GEU est
de 10 % et le risque de stérilité de 20 % (23).
Chez la femme jeune, toute douleur pelvienne devrait faire sus-
pecter une infection haute à C. trachomatis (salpingite, endo-
métrite). Dans ce cas, la sérologie est utile, montrant un taux
élevé d’IgG anti-C. trachomatis, voire une présence d’IgM. La
recherche directe de la bactérie au niveau de l’endocol et de
l’urètre doit être effectuée, si possible par culture cellulaire ou
DOSSIER
24
La Lettre du Gynécologue - n° 246 - novembre 1999

en utilisant une technique d’amplification génique. Sa positivité
est un argument décisif en faveur de l’étiologie chlamydienne,
mais, en pratique, cette recherche s’avère souvent négative en
cas d’infection haute. Si des prélèvements profonds de cellules
tubaires ou d’exsudat péritonéal sont pratiqués sous cœliosco-
pie, la recherche de C. trachomatis doit être préférentiellement
effectuée par amplification génique du fait du risque d’une
faible charge en bactéries sous forme réplicative.
Chez l’homme, l’infection haute à C. trachomatis est mal
connue. On sait que la bactérie est responsable d’épididymite
chez l’homme jeune, mais son rôle dans les prostatites aiguës
ou chroniques est discuté, et son implication dans la stérilité
masculine est probable, mais reste à démontrer. La mise en
évidence de C. trachomatis dans le sperme était pratiquement
impossible avec les techniques classiques, probablement du
fait d’une très faible quantité de bactéries et d’une diminution
de leur pouvoir infectieux rendant l’isolement difficile en cul-
ture cellulaire. L’utilisation des techniques d’amplification
génique a permis d’obtenir une bonne sensibilité de détection
de C. trachomatis dans le sperme, même s’il persiste des mises
au point nécessaires concernant l’élimination des inhibiteurs
des réactions d’amplification moléculaire et l’évaluation des
sensibilités respectives sur éjaculat total, liquide séminal ou
spermatozoïdes. La recherche dans le sperme doit donc être
effectuée préférentiellement par amplification génique. Toute-
fois, la nomenclature précise que cette recherche doit être
effectuée par technique d’hybridation moléculaire ou culture
cellulaire en cas d’infection aiguë pour un premier diagnostic
avant traitement, par culture cellulaire après traitement d’une
infection aiguë, et par technique d’amplification génique en
cas d’infection chronique et/ou exploration d’une éventuelle
hypofertilité. Il faut systématiquement rechercher en parallèle
la bactérie dans l’urètre ou sur le premier jet d’urine, car seule
une recherche positive dans le sperme et négative dans les
urines signera avec certitude l’infection “haute”. La positivité
sur les deux prélèvements peut correspondre à une contamina-
tion du sperme au moment de l’éjaculation, au contact de l’épi-
thélium du canal urétral infecté. Selon la nomenclature, le
laboratoire doit effectuer les deux recherches, mais ne peut en
facturer qu’une (une seule cotation par patient).
25
La Lettre du Gynécologue - n° 246 - novembre 1999
 6
6
 7
7
 8
8
1
/
8
100%