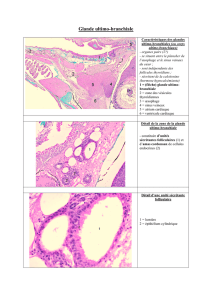
Mini-revue Mise au point sur le traitement chirurgical du cancer du

Mini-revue
Mise au point
sur le traitement chirurgical
du cancer du bas œsophage
Christophe Mariette
Service de chirurgie digestive et générale, Hôpital C. Huriez,
CHRU et Université de Lille II, place de Verdun, 59037 Lille cedex
Dans le traitement à visée curative des cancers du bas œsophage,
plusieurs options thérapeutiques sont envisageables, la chirurgie
étant traditionnellement considérée comme la technique la mieux
adaptée afin d’obtenir un contrôle locorégional de la maladie et
une survie à long terme. Après un bilan d’opérabilité et d’extension
de la maladie le plus exhaustif possible seront sélectionnés les
candidats à une chirurgie d’exérèse à visée curative. La prise en
charge périopératoire est essentielle et actuellement bien standar-
disée, devant couvrir notamment les aspects nutritionnels, analgé-
siques, ventilatoires per et postopératoires et de surveillance inten-
sive des complications potentielles. Une exérèse tumorale en bloc
par double voie d’abord abdominale et thoracique droite et curage
à deux champs, avec rétablissement de la continuité digestive par
gastroplastie, est la technique de choix dans cette indication. Le
bénéfice et la place de la chirurgie mini-invasive restent à détermi-
ner. Avec une mortalité postopératoire désormais inférieure à 5 %
et une morbidité globale moyenne de 35 %, la chirurgie permet
des survies à long terme avec globalement 30 % de patients
survivants à 5 ans et 40 voire 50 % pour ceux opérés dans une
visée curative (R0). L’expertise du centre apparaît comme un
facteur déterminant dans la diminution de la morbi-mortalité posto-
pératoire et l’amélioration du pronostic. Néanmoins, la chirurgie
s’envisage de plus en plus dans le cadre de stratégies thérapeuti-
ques multimodales comportant de la chimiothérapie ou de la
radiochimiothérapie en situation néoadjuvante, en particulier en
cas d’envahissement ganglionnaire et/ou de tumeurs localement
avancées. L’avenir est à un dépistage plus précoce de la maladie,
à une amélioration de l’évaluation de l’extension de la maladie en
préthérapeutique ou après traitement néoadjuvant, à l’améliora-
tion et la standardisation des techniques opératoires et périopéra-
toires et à une potentialisation des traitements néoadjuvants, ce qui
conduit à une stratégie de traitement à la carte pour chaque patient
en fonction de chacun des stades évolutifs de la tumeur.
Mots clés : cancer de l’œsophage, chirurgie, morbidité, mortalité, survie
Hépato-Gastro, vol. 14, n°4, juillet-août 2007
Tirés à part : C. Mariette
265
doi: 10.1684/hpg.2007.0109
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 24/05/2017.

Le cancer de l’œsophage représente le neuvième
cancer le plus fréquent à travers le monde et le
cinquième dans les pays industrialisés. Il repré-
sente environ 15 % des tumeurs malignes du tube
digestif en France. Malgré de nombreux progrès dans
le dépistage, le diagnostic, le bilan d’extension et le
traitement, le pronostic de ce cancer reste sombre.
Seulement 30 % des patients peuvent bénéficier d’un
traitement chirurgical. La survie à 5 ans de l’ensemble
des patients est inférieure à 10 % et passe à 30 voire
40 % pour les patients opérés à visée curative.
Dans le traitement à visée curative du cancer de
l’œsophage, plusieurs options thérapeutiques sont
envisageables, la chirurgie étant traditionnellement
considérée comme la technique la mieux adaptée afin
d’obtenir un contrôle locorégional de la maladie et une
survie à long terme. Compte tenu de la sévérité du
pronostic, une approche multidisciplinaire est néces-
saire, faisant intervenir la chirurgie, la radiothérapie et
la chimiothérapie, seules ou en association, en fonction
des différentes présentations cliniques. Nous n’aborde-
rons dans cette mise au point que le traitement chirur-
gical des cancers du bas œsophage, localisation la
plus fréquente (figure 1) et proposerons une stratégie
thérapeutique par stade TNM précisant la place de la
chirurgie.
Bilan préthérapeutique
Même si la chirurgie ne représente plus l’unique traite-
ment à visée curative du cancer de l’œsophage, le
bilan préthérapeutique a pour but de déterminer la
résécabilité éventuelle de la tumeur et la capacité du
patient à supporter une intervention chirurgicale.
Bilan d’opérabilité
Il comporte une évaluation de l’état nutritionnel, de la
fonction respiratoire, hépatique et cardiovasculaire. Le
bilan est d’autant plus impératif que ces patients ont un
lourd passé alcoolo-tabagique avec une dénutrition qui
peut être importante. L’âge avancé ne représente plus
à lui seul une contre-indication à la chirurgie d’exérèse.
L’état nutritionnel doit être correctement apprécié car
l’association d’une anorexie à la dysphagie peut
aggraver l’amaigrissement. Son évaluation comporte
le calcul des prises caloriques journalières et du pour-
centage d’amaigrissement. Les autres paramètres
(mesures anthropométriques, dosage des protéines
plasmatiques à demi-vie courte, retentissement immu-
nologique) sont moins utilisés. Une perte de poids de
plus de 20 % est une contre-indication absolue à la
chirurgie, mais aussi à une chimiothérapie et nécessite
une assistance nutritionnelle. Une nutrition artificielle
préopératoire n’est recommandée que chez les
patients dénutris (≥10 %), au mieux par voie entérale.
Une immuno-nutrition est également recommandée et
ce quel que soit l’état nutritionnel des patients (dénutris
ou non dénutris) avant une chirurgie carcinologique
majeure, a fortiori de type œsophagectomie [1]. Elles
permettent une réduction significative des complica-
tions postopératoires, en particulier infectieuses, de la
durée de séjour hospitalier et des coûts. Leur intérêt sur
la réduction de la mortalité n’est pas démontré.
L’évaluation de la fonction respiratoire est fondamen-
tale du fait de la fréquente intoxication tabagique, du
terrain et de la nécessité habituelle d’une thoracotomie
pour l’exérèse œsophagienne. En plus de l’examen
clinique, la radiographie et la tomodensitométrie tho-
raciques, la gazométrie artérielle et les épreuves fonc-
tionnelles respiratoires doivent permettre de sélection-
ner les candidats à une chirurgie d’exérèse précédée
ou non d’une préparation respiratoire.
La fonction hépatique doit être évaluée, un bilan biolo-
gique perturbé imposant une ponction-biopsie du foie.
Une cirrhose n’est pas une contre-indication en soi à la
chirurgie si le malade se trouve au stade A de Child et
si le taux de prothrombine est supérieur à 60 %. La
présence d’une hépatite alcoolique incite à différer
l’intervention jusqu’à la normalisation du bilan hépati-
que grâce au sevrage. L’insuffisance hépatocellulaire
et/ou une hypertension portale nette contre-indiquent
l’intervention.
L’évaluation de la fonction cardiaque, clinique éven-
tuellement associée à une échographie cardiaque et à
une épreuve d’effort, doit permettre de dépister une
insuffisance cardiaque, un angor instable ou des
antécédents récents d’infarctus qui sont des contre-
indications à l’intervention, mais également à l’emploi
de la chimiothérapie par le 5-fluorouracile et le
Œsophage
Estomac
Tumeur
Figure 1.Pièce d’œsophagectomie et de gastrectomie polaire
supérieure pour adénocarcinome du bas œsophage.
Mini-revue
Hépato-Gastro, vol. 14, n°4, juillet-août 2007
266
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 24/05/2017.

cisplatine. Une neuropathie périphérique ou une insuf-
fisance rénale contre-indique également le cisplatine.
En conclusion, seuls les patients présentant un score de
l’American Society of Anesthesiologists (ASA) inférieur
à 3 peuvent être proposés à la chirurgie.
Bilan d’extension préthérapeutique
Ce bilan a pour double objectif d’évaluer, d’une part,
la résécabilité de la tumeur et, d’autre part, d’appré-
cier son extension locorégionale et à distance.
• Diagnostic
L’endoscopie œsogastrique avec biopsies (à répéter si
celles-ci sont initialement négatives), et mesure des
distances par rapport aux arcades dentaires, est l’exa-
men de référence (figure 2). Une coloration vitale
(lugol, bleu de Toluidine) est recommandée pour mieux
apprécier les limites tumorales ou pour rechercher une
deuxième localisation œsophagienne.
• Bilan d’extension
Le délai entre la réalisation des examens du bilan
d’extension et la décision thérapeutique doit être le
plus court possible, et ne devrait pas dépasser un mois.
En première intention, il convient de réaliser : un exa-
men clinique complet ; une tomodensitométrie thoraco-
abdominale, sensible et spécifique pour le diagnostic
de métastases viscérales (hépatiques et pulmonaires) ;
une fibroscopie trachéobronchique afin d’éliminer une
extension muqueuse trachéobronchique ou une
deuxième localisation tumorale. Elle est non systémati-
que pour les adénocarcinomes du tiers inférieur chez
un non-fumeur ; un examen ORL avec laryngoscopie
indirecte, à la recherche d’une paralysie récurrentielle,
d’un cancer ORL synchrone.
En seconde intention, en l’absence de métastases sur
les examens précédents, il convient de réaliser une
échoendoscopie, sauf en cas de tumeur localement
évoluée ou métastatique. Elle est complétée par une
ponction pour confirmation histologique d’adénopa-
thies cœliaques. L’échoendoscopie par minisons de
haute fréquence (20–30 MHz) permet seule de poser
le diagnostic de cancer superficiel et d’indiquer un
traitement endoscopique : parmi les neuf couches indi-
vidualisées dans la paroi œsophagienne, la plus
importante est la quatrième couche hypo-échogène qui
correspond à la musculaire muqueuse, et dont le fran-
chissement traduit l’infiltration de la sous-muqueuse par
la tumeur. On réalisera une scintigraphie osseuse et
une tomodensitométrie cérébrale seulement en cas de
signes d’appel.
En option peuvent être réalisées :
1)une radiographie thoracique ;
2)une échographie abdominale ;
3)une échographie sus-claviculaire ± cytoponction
échoguidée, pour obtenir une confirmation cyto ou
histologique d’adénopathies cervicales ;
4)une tomographie à émission de positrons, ayant
une plus grande précision diagnostique que l’associa-
tion tomodensitométrie–échoendoscopie pour la détec-
tion des métastases à distance. Elle a théoriquement sa
place lorsque tomodensitométrie et échoendoscopie
concluent à une tumeur non métastatique, et qu’une
résection est envisagée. Il faut essayer de confirmer la
nature métastatique des anomalies repérées seulement
par la TEP ;
5)une laparoscopie ± échographie per-laparosco-
pique, son apport semblant intéressant pour les adéno-
carcinomes du cardia et du tiers inférieur de l’œso-
phage ;
6)un transit œsogastroduodénal qui localise la
tumeur, permet la mesure de sa longueur, note une
désaxation éventuelle (signe péjoratif) et apprécie les
dimensions de l’estomac.
• Recherche de cancers
épidémiologiquement associés
La recherche d’un cancer ORL se fait par examen ORL
et panendoscopie sous anesthésie générale. La recher-
che d’un cancer broncho-pulmonaire se fait par fibros-
copie trachéobronchique. La recherche d’un cancer
ORL ou trachéobronchique, indispensable en cas de
carcinome épidermoïde, est conseillée chez les
patients fumeurs présentant un adénocarcinome de
l’œsophage.
Conditions de la chirurgie
des cancers du bas œsophage
Le choix de la technique chirurgicale dépend de plu-
sieurs facteurs : l’état général du patient (score ASA), le
bilan préopératoire, les constations peropératoires et
Figure 2.Adénocarcinome du bas œsophage : vue endoscopique.
Hépato-Gastro, vol. 14, n°4, juillet-août 2007 267
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 24/05/2017.

la philosophie du chirurgien quant à l’étendue de la
résection et la technique de reconstruction. Historique-
ment, la résection locorégionale étendue était considé-
rée comme inadaptée pour éradiquer la maladie et le
curage ganglionnaire comme probablement inutile.
L’ablation de la tumeur primitive par voie transhiatale
semblait donner les mêmes taux de survie à long terme
que les résections en bloc plus étendues. De nos jours,
à l’inverse, la résection R0 est considérée comme le
facteur pronostique le plus important dans le cancer de
l’œsophage et ce type de résection ne peut être réalisé
que par une résection en bloc de la tumeur primitive et
des ganglions régionaux.
Mise en condition préopératoire
Le management préopératoire d’un patient qui doit
bénéficier d’un geste d’exérèse œsophagienne doit
comporter plusieurs aspects. L’intoxication tabagique
doit être arrêtée au moins 1 mois avant la chirurgie.
Une kinésithérapie respiratoire associée aux fluidi-
fiants bronchiques en aérosols et aux médicaments
bronchodilatateurs est conseillée en préopératoire.
Une hygiène buccale et dentaire doit être imposée car
les bactéries anaérobies peuvent être une source
d’infection médiastinale et de pneumopathie. En cas
de dénutrition (perte ≥10 % du poids de forme), une
nutrition au mieux entérale doit être proposée pour une
période préopératoire d’au moins 7 jours. L’alimenta-
tion orale doit être facilitée en préopératoire par dila-
tation au ballon ou par gastrostomie percutanée
(endoscopique ou radiologique), cette dernière ne
contre-indiquant pas un geste ultérieur d’œsophagec-
tomie avec gastroplastie. La gastrostomie chirurgicale
doit être évitée, car plus morbide. Une immuno-
nutrition (type Oral Impact
®
Novartis Nutrition, une
brique 3 fois par jour pendant 7 jours en préopéra-
toire) est recommandée et ce, quel que soit l’état
nutritionnel des patients (dénutris ou non dénutris) [1].
Un prélèvement des expectorations bronchiques peut
être proposé, avec cultures aérobies et anaérobies,
afin de sélectionner des antibiotiques efficaces. Enfin,
une antibioprophylaxie ainsi qu’une thromboprophy-
laxie doivent être systématiquement envisagées dans la
période périopératoire.
Contre-indications
L’expérience du chirurgien ainsi que l’état général du
patient ont été identifiés comme les principaux facteurs
de mortalité postopératoire après œsophagectomie.
L’opérabilité du patient doit donc être évaluée avec,
comme critères de non-opérabilité généralement rete-
nus : la cirrhose avec insuffisance hépatocellulaire
et/ou hypertension portale, l’insuffisance respiratoire,
le volume expiratoire maximal/seconde (VEMS) infé-
rieur à 1000 mL/s, la perte de poids supérieure à
20 % du poids de forme et l’insuffisance cardiaque
stade III ou IV de la New York Heart Association
(NYHA).
Les critères de non-résécabilité habituellement retenus
sont : les adhérences à l’aorte sur plus de 90° de sa
circonférence, l’envahissement trachéobronchique,
azygos ou récurrentiel, le diamètre tumoral supérieur à
4 cm, les adénopathies cœliaques (excepté pour les
cancers de la jonction œsogastrique) ou sus-
claviculaires, les métastases viscérales.
Technique chirurgicale
Voies d’abord
L’œsophage peut être abordé par les 3 voies suivan-
tes : laparotomie-thoracotomie droite, laparotomie-
thoracotomie gauche ou transhiatale (figure 3).
L’œsophagectomie par double abord abdominal et
thoracique postéro-latéral droit offre l’accès le plus
direct à l’œsophage et facilite le curage abdominal et
médiastinal. Elle est indiquée pour toutes les tumeurs
intrathoraciques situées sous la crosse de la veine
azygos et est la voie d’abord préférée de la plupart des
chirurgiens. Cette approche permet une œsophagecto-
mie en bloc ainsi qu’une bonne exposition pour un
curage ganglionnaire régional étendu. Un abord cer-
vical complémentaire peut être réalisé pour l’anasto-
mose.
La voie transthoracique gauche, préférée des chirur-
giens chinois, permet la mobilisation de l’estomac par
la même voie d’abord, sous réserve d’une incision
diaphragmatique. Elle est principalement indiquée
pour les lésions du cardia et de l’œsophage distal [2].
L’œsophagectomie sans thoracotomie, ou voie
transhiatale, est principalement utilisée pour l’exérèse
des tumeurs de l’hypopharynx et de l’œsophage cervi-
cal, ainsi que pour l’exérèse des tumeurs intraépithé-
liales de l’œsophage intrathoracique. Elle est réalisée
par dissection à l’aveugle de l’œsophage thoracique
par double incision cervicale et abdominale. Cette
technique permet uniquement l’ablation des ganglions
périœsophagiens.
En conclusion, la laparotomie-thoracotomie droite (ou
intervention de Lewis-Santy) est l’intervention de réfé-
rence dans le traitement à visée curative des cancers du
bas œsophage.
Techniques de reconstruction
L’estomac est l’organe le plus couramment utilisé dans
la reconstruction après œsophagectomie. Après mobi-
lisation extensive du duodénum et de la racine du
Mini-revue
Hépato-Gastro, vol. 14, n°4, juillet-août 2007
268
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 24/05/2017.

mésentère, l’estomac peut être amené jusqu’en base de
langue. L’œsophagectomie implique une vagotomie
tronculaire bilatérale avec, par conséquent, des trou-
bles potentiels de la vidange gastrique, raison pour
laquelle une pyloroplastie est habituellement réalisée.
Dans une étude prospective randomisée comparant la
pyloroplastie à l’absence de manœuvre favorisant la
vidange gastrique chez 200 patients, il n’existait pas
de morbidité ajoutée dans le groupe pyloroplastie. Un
total de 13 patients du groupe contrôle et seulement
deux patients du groupe pyloroplastie ont présenté des
troubles de la vidange gastrique obligeant à une ali-
mentation parentérale prolongée ; quatre patients ont
développé des complications pulmonaires associées à
une distension gastrique, résultant en une inhalation
fatale chez deux patients [3].
La principale alternative à la gastroplastie est l’utilisa-
tion d’une plastie colique. Étant donné la plus grande
complexité du geste de transposition colique et la
moins bonne vascularisation du greffon, cette techni-
que doit être réservée aux patients présentant des
antécédents de chirurgie gastrique ou présentant une
pathologie gastrique concomitante. Par ailleurs, la
durée d’intervention est plus longue et nécessite deux
anastomoses au lieu d’une. Le côlon transposé doit être
placé en isopéristaltique. Pour une plastie colique
droite et transverse, le côlon peut être pédiculisé sur
l’artère colique moyenne ; pour une plastie colique
AB
C
Figure 3.Représentation schématique des différentes approches et méthodes de reconstruction par gastroplastie après œsophagectomie.
A) Laparo-thoracotomie droite (intervention de Lewis-Santy) ; B) laparotomie–cervicotomie gauche (œsophagectomie sans thoracotomie) et
C) laparotomie–cervicotomie gauche–thoracotomie droite (intervention de Akiyama). (D’après Mariette et Triboulet, Encyclopédie Médico-
Chirurgicale 2004).
Hépato-Gastro, vol. 14, n°4, juillet-août 2007 269
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 24/05/2017.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
1
/
14
100%