Cycle de Krebs

C- Le cycle de KREBS, ou cycle du citrate
!
I- Introduction
!
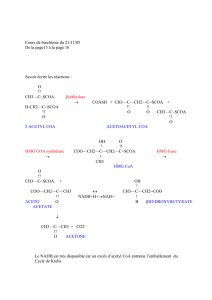
Le premier composé synthétisé est le citrate.
Le composé qui rentre dans le cycle est l'acéthyl CoA, ce cycle correspond a la voie finale
commune de l'oxydation des glucides, lipides et protéines et se situe dans la mitochondrie.
Carrefour métabolique, qui va utiliser l'acétylCoA de manière a le dégrader en CO2 et
H2O, de manière a obtenir des composés riches en énergie pour aboutir a la synthèse
d'ATP dans la chaine respiratoire. Tous les composés vont converger vers le cycle de
Krebs pour leur dégradation.
1
CYCLE DU CITRATE OU CYCLE DE KREBS
CYCLE DU CITRATE OU CYCLE DE KREBS
I
I –
–INTRODUCTION:
INTRODUCTION:
Voie finale commune de l
Voie finale commune de l’
’oxydation des glucides, lipides et prot
oxydation des glucides, lipides et proté
éines
ines
(mitochondrie)
(mitochondrie)
II
II -
-DIFFERENTES ETAPES
DIFFERENTES ETAPES
III
III -
-BILAN ENERGETIQUE DU CYCLE
BILAN ENERGETIQUE DU CYCLE
IV
IV -
-ROLE AMPHIBOLIQUE DU CYCLE TRICARBOXYLIQUE
ROLE AMPHIBOLIQUE DU CYCLE TRICARBOXYLIQUE
V
V -
-FORMATION D
FORMATION D ’
’OXALOACETATE ou REACTIONS ANAPL
OXALOACETATE ou REACTIONS ANAPLÉ
ÉROTIQUES
ROTIQUES
VI
VI -
-REGULATION DU CYCLE DE KREBS
REGULATION DU CYCLE DE KREBS
2 CO
2
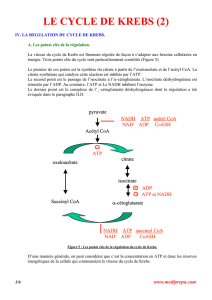
METABOLISME CELLULAIRE
METABOLISME CELLULAIRE
Acétyl-CoA
Chaîne respiratoire
H
+
et é ATP
Amino acides Glucides Acides gras
KREBS
KREBS
Pyruvate
Glycolyse
Glycolyse !
!!!
!
!!!-
-oxydation
oxydation
"
"""G
0’
= - 32,2 kJ/mol: étape irréversible
H
2
O
HSCoA
CSCoA
O
CH
3
CYCLE DE KREBS
CYCLE DE KREBS
II
II -
-DIFFERENTES ETAPES
DIFFERENTES ETAPES
1°- Synthèse du citrate:
Condensation de l’acétyle par son groupement méthyle
+
COO
-
C
CH
2
HO COO
-
COO
-
CH
2
COO
-
CO
COO
-
CH
2
Oxaloac
Oxaloacé
étate
tate
Citrate
Citrate
Citrate
Citrate synthase
synthase
H
2
O
H
2
O
COO
-
C
CH
2
COO
-
COO
-
CH
H
2
O
H
2
O
2
2°
°-
-Isom
Isomé
érisation en
risation en Isocitrate
Isocitrate :
:
Cisaconitate
Cisaconitate Isocitrate
Isocitrate
Aconitase
Aconitase (Centre
(Centre Fe
Fe-
-S
S)
)
COO
-
CH
CH
2
HO
COO
-
COO
-
CH
R
Ré
éaction inhib
action inhibé
ée par le
e par le fluoroac
fluoroacé
étate
tate:
:
fluoroac
fluoroacé
étylCoA
tylCoA + OA
+ OA !
!!!
!
!!!fluorocitrate
fluorocitrate
II- Les différentes étapes du cycle de krebs
!
Les différentes étapes se situent dans la mitochondrie
1- Synthèse du citrate
Par condensation de l'acétyle par son groupement méthyle, départ du coenzyme A, on
obtient a partir de lʼoxaloacétate du citrate (acide tricarboxylique appelé le citrate).
L'enzyme est la citrate synthase.
Une valeur de delta G0' fortement négative, étape irréversible qui ne fonctionne que dans
un seul sens.
1
CYCLE DU CITRATE OU CYCLE DE KREBS
CYCLE DU CITRATE OU CYCLE DE KREBS
I
I –
–INTRODUCTION:
INTRODUCTION:
Voie finale commune de l
Voie finale commune de l’
’oxydation des glucides, lipides et prot
oxydation des glucides, lipides et proté
éines
ines
(mitochondrie)
(mitochondrie)
II
II -
-DIFFERENTES ETAPES
DIFFERENTES ETAPES
III
III -
-BILAN ENERGETIQUE DU CYCLE
BILAN ENERGETIQUE DU CYCLE
IV
IV -
-ROLE AMPHIBOLIQUE DU CYCLE TRICARBOXYLIQUE
ROLE AMPHIBOLIQUE DU CYCLE TRICARBOXYLIQUE
V
V -
-FORMATION D
FORMATION D ’
’OXALOACETATE ou REACTIONS ANAPL
OXALOACETATE ou REACTIONS ANAPLÉ
ÉROTIQUES
ROTIQUES
VI
VI -
-REGULATION DU CYCLE DE KREBS
REGULATION DU CYCLE DE KREBS
2 CO
2
METABOLISME CELLULAIRE
METABOLISME CELLULAIRE
Acétyl-CoA
Chaîne respiratoire
H
+
et é ATP
Amino acides Glucides Acides gras
KREBS
KREBS
Pyruvate
Glycolyse
Glycolyse !
!!!
!
!!!-
-oxydation
oxydation
"
"""G
0’
= - 32,2 kJ/mol: étape irréversible
H
2
O
HSCoA
CSCoA
O
CH
3
CYCLE DE KREBS
CYCLE DE KREBS
II
II -
-DIFFERENTES ETAPES
DIFFERENTES ETAPES
1°- Synthèse du citrate:
Condensation de l’acétyle par son groupement méthyle
+
COO
-
C
CH
2
HO COO
-
COO
-
CH
2
COO
-
CO
COO
-
CH
2
Oxaloac
Oxaloacé
étate
tate
Citrate
Citrate
Citrate
Citrate synthase
synthase
H
2
O
H
2
O
COO
-
C
CH
2
COO
-
COO
-
CH
H
2
O
H
2
O
2
2°
°-
-Isom
Isomé
érisation en
risation en Isocitrate
Isocitrate :
:
Cisaconitate
Cisaconitate Isocitrate
Isocitrate
Aconitase
Aconitase (Centre
(Centre Fe
Fe-
-S
S)
)
COO
-
CH
CH
2
HO
COO
-
COO
-
CH
R
Ré
éaction inhib
action inhibé
ée par le
e par le fluoroac
fluoroacé
étate
tate:
:
fluoroac
fluoroacé
étylCoA
tylCoA + OA
+ OA !
!!!
!
!!!fluorocitrate
fluorocitrate

2- Isomérisation en isocitrate
Réaction qui déplace le OH .
Enzyme: aconitase
Pour faire cette réaction on passe par une déshydratation on a un cicaconitate, puis une
hydratation et on a lʼisocitrate.
Réaction réversible inhibée par le fluoroacétate, cʼest un poison très violent, qui permet
aux plantes de se défendre des herbivores. On obtient du fluorocitrate par la réaction avec
lʼacétyl CoA.
1
CYCLE DU CITRATE OU CYCLE DE KREBS
CYCLE DU CITRATE OU CYCLE DE KREBS
I
I –
–INTRODUCTION:
INTRODUCTION:
Voie finale commune de l
Voie finale commune de l’
’oxydation des glucides, lipides et prot
oxydation des glucides, lipides et proté
éines
ines
(mitochondrie)
(mitochondrie)
II
II -
-DIFFERENTES ETAPES
DIFFERENTES ETAPES
III
III -
-BILAN ENERGETIQUE DU CYCLE
BILAN ENERGETIQUE DU CYCLE
IV
IV -
-ROLE AMPHIBOLIQUE DU CYCLE TRICARBOXYLIQUE
ROLE AMPHIBOLIQUE DU CYCLE TRICARBOXYLIQUE
V
V -
-FORMATION D
FORMATION D ’
’OXALOACETATE ou REACTIONS ANAPL
OXALOACETATE ou REACTIONS ANAPLÉ
ÉROTIQUES
ROTIQUES
VI
VI -
-REGULATION DU CYCLE DE KREBS
REGULATION DU CYCLE DE KREBS
2 CO
2
METABOLISME CELLULAIRE
METABOLISME CELLULAIRE
Acétyl-CoA
Chaîne respiratoire
H
+
et é ATP
Amino acides Glucides Acides gras
KREBS
KREBS
Pyruvate
Glycolyse
Glycolyse !
!!!
!
!!!-
-oxydation
oxydation
"
"""G
0’
= - 32,2 kJ/mol: étape irréversible
H
2
O
HSCoA
CSCoA
O
CH
3
CYCLE DE KREBS
CYCLE DE KREBS
II
II -
-DIFFERENTES ETAPES
DIFFERENTES ETAPES
1°- Synthèse du citrate:
Condensation de l’acétyle par son groupement méthyle
+
COO
-
C
CH
2
HO COO
-
COO
-
CH
2
COO
-
CO
COO
-
CH
2
Oxaloac
Oxaloacé
étate
tate
Citrate
Citrate
Citrate
Citrate synthase
synthase
H
2
O
H
2
O
COO
-
C
CH
2
COO
-
COO
-
CH
H
2
O
H
2
O
2
2°
°-
-Isom
Isomé
érisation en
risation en Isocitrate
Isocitrate :
:
Cisaconitate
Cisaconitate Isocitrate
Isocitrate
Aconitase
Aconitase (Centre
(Centre Fe
Fe-
-S
S)
)
COO
-
CH
CH
2
HO
COO
-
COO
-
CH
R
Ré
éaction inhib
action inhibé
ée par le
e par le fluoroac
fluoroacé
étate
tate:
:
fluoroac
fluoroacé
étylCoA
tylCoA + OA
+ OA !
!!!
!
!!!fluorocitrate
fluorocitrate
3- Oxydation et décarboxylation de lʼisocitrate
!
Enzyme: isocitrate déshydrogénase
Hydrolyse de l'isocitrate, On a un composé intermédiaire: oxalosuccinate (composé béta
cétonique) qui se décarboxyle spontanément, pour aboutir à l'alpha cétoglutarate (fonction
cétone).
Cette oxydation et décarboxylation est une étape irréversible, car delta G0' < 0.
2
3
3°
°-
-Oxydation et d
Oxydation et dé
écarboxylation de l
carboxylation de l ’
’isocitrate
isocitrate
COO
-
CH
2
CH
2
COO
-
CO
COO
-
CH
CH
2
O
COO
-
COO
-
C
CO
2
NAD
+
NADH + H
+
Isocitrate
Isocitrate
deshydrog
deshydrogé
énase
nase
Oxalosuccinate
Oxalosuccinate !
!!!
!
!!!-
-c
cé
étoglutarate
toglutarate
"
"""G
0’
= - 20,9 kJ/mol : étape irréversible
4
4°
°-
-D
Dé
écarboxylation oxydative de l
carboxylation oxydative de l ’
’!
!!!
!
!!!-
-c
cé
étoglu
toglu en
en succinyl
succinyl-
-CoA
CoA
CH
2
CH
2
CO-COO
-
COO
-
CO
2
CoASH
NAD
+
NADH + H
+
Succinyl
Succinyl-
-CoA
CoA
Complexe
Complexe !
!!!
!
!!!-
-c
cé
étoglutarate
toglutarate deshydrog
deshydrogé
énase
nase:
:
3 prot
3 proté
éines enzymatiques et 5 coenzymes
ines enzymatiques et 5 coenzymes
(structure voisine de celle de la pyruvate
(structure voisine de celle de la pyruvate deshydrog
deshydrogé
énase
nase,
,
en particulier E3 identique
en particulier E3 identique à
àl
l’
’enzyme du complexe PDH
enzyme du complexe PDH)
)
CoA
CH
2
CH
2
COO
-
CS
O
!
!!!
!
!!!-
-C
Cé
étoglutarate
toglutarate
"
"""G0’ = - 33,5 kJ/mol : étape irréversible
Sch
Sché
éma de l
ma de l ’
’oxydation de l
oxydation de l ’
’!
!!!
!
!!!-
-c
cé
étoglutarate
toglutarate en
en succinyl
succinyl-
-CoA
CoA
CO
2
TDP-E1
E1 =
E1 =
!
!!!
!
!!!-
-c
cé
étoglutarate
toglutarate
deshydrog
deshydrogé
énase
nase
E2 =
E2 =
dihydrolipoamide
dihydrolipoamide
transsuccinylase
transsuccinylase
CO CH
2
E2-L
SH
S~
HSCoA
~
SCoA
E3-FADH
2
E2-L
S
S
E2-L
SH
S
H
E3-FAD
E3 =
E3 =
Dihydrolipoamide
Dihydrolipoamide
deshydrog
deshydrogé
énase
nase
NAD
+
NADH + H
+
CH
2
CH
2
CO-COO
-
COO
-
CH
2
CH
2
-CO
COO
-
CH
2
COO
-
CH
2
CH
2
CHOH TDP-E1
COO
-
Succinyl
Succinyl-
-CoA
CoA
!
!!!
!
!!!-
-C
Cé
étoglu
toglu
CoA
CH
2
CH
2
COO
-
CS
O
5
5°
°-
-Formation du
Formation du succinate
succinate
CH
2
CH
2
COO
-
COO
-
+
HSCoA
Succinyl
Succinyl-
-CoA
CoA synth
synthé
étase
tase
Compos
Composé
éinterm
intermé
édiaire
diaire succinyl
succinyl phosphate
phosphate
GDP + Pi GTP
Succinate
Succinate
ADP
ATP
Succinyl
Succinyl-
-CoA
CoA
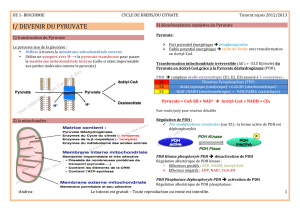
4- Décarboxylation oxydative de l'alpha cétoglutarate en succinyl-CoA
Décarboxylation en même temps qu'une oxydation par le complexe alpha cétoglutarate
déshydrogénase, semblable à celui du complexe de la pyruvate déshydrogénase
(3 protéines enzymatique couplées a des coenzymes).
(l'enzyme E3 est identique a celle du complexe PDH)
L'accepteur final est le NAD+ qui est transformé en NADH
On obtient le succinyl CoA
Réaction irréversible car delta G0' < 0 (-33,5 kJ/mol)

2
3
3°
°-
-Oxydation et d
Oxydation et dé
écarboxylation de l
carboxylation de l ’
’isocitrate
isocitrate
COO
-
CH
2
CH
2
COO
-
CO
COO
-
CH
CH
2
O
COO
-
COO
-
C
CO
2
NAD
+
NADH + H
+
Isocitrate
Isocitrate
deshydrog
deshydrogé
énase
nase
Oxalosuccinate
Oxalosuccinate !
!!!
!
!!!-
-c
cé
étoglutarate
toglutarate
"
"""G
0’
= - 20,9 kJ/mol : étape irréversible
4
4°
°-
-D
Dé
écarboxylation oxydative de l
carboxylation oxydative de l ’
’!
!!!
!
!!!-
-c
cé
étoglu
toglu en
en succinyl
succinyl-
-CoA
CoA
CH
2
CH
2
CO-COO
-
COO
-
CO
2
CoASH
NAD
+
NADH + H
+
Succinyl
Succinyl-
-CoA
CoA
Complexe
Complexe !
!!!
!
!!!-
-c
cé
étoglutarate
toglutarate deshydrog
deshydrogé
énase
nase:
:
3 prot
3 proté
éines enzymatiques et 5 coenzymes
ines enzymatiques et 5 coenzymes
(structure voisine de celle de la pyruvate
(structure voisine de celle de la pyruvate deshydrog
deshydrogé
énase
nase,
,
en particulier E3 identique
en particulier E3 identique à
àl
l’
’enzyme du complexe PDH
enzyme du complexe PDH)
)
CoA
CH
2
CH
2
COO
-
CS
O
!
!!!
!
!!!-
-C
Cé
étoglutarate
toglutarate
"
"""G0’ = - 33,5 kJ/mol : étape irréversible
Sch
Sché
éma de l
ma de l ’
’oxydation de l
oxydation de l ’
’!
!!!
!
!!!-
-c
cé
étoglutarate
toglutarate en
en succinyl
succinyl-
-CoA
CoA
CO
2
TDP-E1
E1 =
E1 =
!
!!!
!
!!!-
-c
cé
étoglutarate
toglutarate
deshydrog
deshydrogé
énase
nase
E2 =
E2 =
dihydrolipoamide
dihydrolipoamide
transsuccinylase
transsuccinylase
CO CH
2
E2-L
SH
S~
HSCoA
~
SCoA
E3-FADH
2
E2-L
S
S
E2-L
SH
S
H
E3-FAD
E3 =
E3 =
Dihydrolipoamide
Dihydrolipoamide
deshydrog
deshydrogé
énase
nase
NAD
+
NADH + H
+
CH
2
CH
2
CO-COO
-
COO
-
CH
2
CH
2
-CO
COO
-
CH
2
COO
-
CH
2
CH
2
CHOH TDP-E1
COO
-
Succinyl
Succinyl-
-CoA
CoA
!
!!!
!
!!!-
-C
Cé
étoglu
toglu
CoA
CH
2
CH
2
COO
-
CS
O
5
5°
°-
-Formation du
Formation du succinate
succinate
CH
2
CH
2
COO
-
COO
-
+
HSCoA
Succinyl
Succinyl-
-CoA
CoA synth
synthé
étase
tase
Compos
Composé
éinterm
intermé
édiaire
diaire succinyl
succinyl phosphate
phosphate
GDP + Pi GTP
Succinate
Succinate
ADP
ATP
Succinyl
Succinyl-
-CoA
CoA
Schéma de l'oxydation de l'alpha cétoglutarate
2
3
3°
°-
-Oxydation et d
Oxydation et dé
écarboxylation de l
carboxylation de l ’
’isocitrate
isocitrate
COO
-
CH
2
CH
2
COO
-
CO
COO
-
CH
CH
2
O
COO
-
COO
-
C
CO
2
NAD
+
NADH + H
+
Isocitrate
Isocitrate
deshydrog
deshydrogé
énase
nase
Oxalosuccinate
Oxalosuccinate !
!!!
!
!!!-
-c
cé
étoglutarate
toglutarate
"
"""G
0’
= - 20,9 kJ/mol : étape irréversible
4
4°
°-
-D
Dé
écarboxylation oxydative de l
carboxylation oxydative de l ’
’!
!!!
!
!!!-
-c
cé
étoglu
toglu en
en succinyl
succinyl-
-CoA
CoA
CH
2
CH
2
CO-COO
-
COO
-
CO
2
CoASH
NAD
+
NADH + H
+
Succinyl
Succinyl-
-CoA
CoA
Complexe
Complexe !
!!!
!
!!!-
-c
cé
étoglutarate
toglutarate deshydrog
deshydrogé
énase
nase:
:
3 prot
3 proté
éines enzymatiques et 5 coenzymes
ines enzymatiques et 5 coenzymes
(structure voisine de celle de la pyruvate
(structure voisine de celle de la pyruvate deshydrog
deshydrogé
énase
nase,
,
en particulier E3 identique
en particulier E3 identique à
àl
l’
’enzyme du complexe PDH
enzyme du complexe PDH)
)
CoA
CH
2
CH
2
COO
-
CS
O
!
!!!
!
!!!-
-C
Cé
étoglutarate
toglutarate
"
"""G0’ = - 33,5 kJ/mol : étape irréversible
Sch
Sché
éma de l
ma de l ’
’oxydation de l
oxydation de l ’
’!
!!!
!
!!!-
-c
cé
étoglutarate
toglutarate en
en succinyl
succinyl-
-CoA
CoA
CO
2
TDP-E1
E1 =
E1 =
!
!!!
!
!!!-
-c
cé
étoglutarate
toglutarate
deshydrog
deshydrogé
énase
nase
E2 =
E2 =
dihydrolipoamide
dihydrolipoamide
transsuccinylase
transsuccinylase
CO CH
2
E2-L
SH
S~
HSCoA
~
SCoA
E3-FADH
2
E2-L
S
S
E2-L
SH
S
H
E3-FAD
E3 =
E3 =
Dihydrolipoamide
Dihydrolipoamide
deshydrog
deshydrogé
énase
nase
NAD
+
NADH + H
+
CH
2
CH
2
CO-COO
-
COO
-
CH
2
CH
2
-CO
COO
-
CH
2
COO
-
CH
2
CH
2
CHOH TDP-E1
COO
-
Succinyl
Succinyl-
-CoA
CoA
!
!!!
!
!!!-
-C
Cé
étoglu
toglu
CoA
CH
2
CH
2
COO
-
CS
O
5
5°
°-
-Formation du
Formation du succinate
succinate
CH
2
CH
2
COO
-
COO
-
+
HSCoA
Succinyl
Succinyl-
-CoA
CoA synth
synthé
étase
tase
Compos
Composé
éinterm
intermé
édiaire
diaire succinyl
succinyl phosphate
phosphate
GDP + Pi GTP
Succinate
Succinate
ADP
ATP
Succinyl
Succinyl-
-CoA
CoA
Enzyme E1: alpha cétoglutarate déshydrogénase, couplée à la thiamine diphosphate
Enzyme E2: dihydrolipoamide transsuccinylase ( coenzyme= lipoamide)
Enzyme E3: dihydrolipoamide deshydrogénase, couplée a la FAD.
Première étape, décarboxylation, on transfère le groupement sur la thiamine diphosphate
couplé à E1, on va avoir l'étape d'oxydation avec l'enzyme E2, a partir de cette lipoamide,
on a un complexe alpha cétoglutarate. Transfert du reste de la molécule sur le TDP.
Puis transfère de ce radical succinyl sur le CoA. On a la lipoamide sous forme réduite
(cʼest la dihydrolipoamide), qui est réoxydé par l'enzyme E3. On aboutit a du E3 FADH2.
NAD+ est le coenzyme accepteur final.
5- Formation du succinate
On part du succinyl CoA pour former du succinate.
Cʼest une réaction de transfert. Réaction catalysé par le succinyl CoA synthétase, qui
comporte une phosphorylation au niveau du substrat. Libération d'énergie dissipée sous
forme de chaleur.
Composé intermédiaire, le succinyl phosphate. Si on a la réaction directe on ne peut pas
former une molécule de GTP (cʼest lʼaccepteur qui nʼest pas lʼADP).
Les deux réactions sont couplées par le fait qu'il y a un transfert d'un phosphate sur le
radical succinyl, on conserve l'énergie de la liaison,(le Pi va remplacer le coenzyme A, va
créer une fonction anhydrides mixte, a haut potentiel d'hydrolyse, a ce moment la on peut
transférer le phosphate sur le GDP pour donner le GTP (équivalent de le formation d'ATP
a partir d'ADP).)
On a donc formation d'une molécule d'ATP.

2
3
3°
°-
-Oxydation et d
Oxydation et dé
écarboxylation de l
carboxylation de l ’
’isocitrate
isocitrate
COO
-
CH
2
CH
2
COO
-
CO
COO
-
CH
CH
2
O
COO
-
COO
-
C
CO
2
NAD
+
NADH + H
+
Isocitrate
Isocitrate
deshydrog
deshydrogé
énase
nase
Oxalosuccinate
Oxalosuccinate !
!!!
!
!!!-
-c
cé
étoglutarate
toglutarate
"
"""G
0’
= - 20,9 kJ/mol : étape irréversible
4
4°
°-
-D
Dé
écarboxylation oxydative de l
carboxylation oxydative de l ’
’!
!!!
!
!!!-
-c
cé
étoglu
toglu en
en succinyl
succinyl-
-CoA
CoA
CH
2
CH
2
CO-COO
-
COO
-
CO
2
CoASH
NAD
+
NADH + H
+
Succinyl
Succinyl-
-CoA
CoA
Complexe
Complexe !
!!!
!
!!!-
-c
cé
étoglutarate
toglutarate deshydrog
deshydrogé
énase
nase:
:
3 prot
3 proté
éines enzymatiques et 5 coenzymes
ines enzymatiques et 5 coenzymes
(structure voisine de celle de la pyruvate
(structure voisine de celle de la pyruvate deshydrog
deshydrogé
énase
nase,
,
en particulier E3 identique
en particulier E3 identique à
àl
l’
’enzyme du complexe PDH
enzyme du complexe PDH)
)
CoA
CH
2
CH
2
COO
-
CS
O
!
!!!
!
!!!-
-C
Cé
étoglutarate
toglutarate
"
"""G0’ = - 33,5 kJ/mol : étape irréversible
Sch
Sché
éma de l
ma de l ’
’oxydation de l
oxydation de l ’
’!
!!!
!
!!!-
-c
cé
étoglutarate
toglutarate en
en succinyl
succinyl-
-CoA
CoA
CO
2
TDP-E1
E1 =
E1 =
!
!!!
!
!!!-
-c
cé
étoglutarate
toglutarate
deshydrog
deshydrogé
énase
nase
E2 =
E2 =
dihydrolipoamide
dihydrolipoamide
transsuccinylase
transsuccinylase
CO CH
2
E2-L
SH
S~
HSCoA
~
SCoA
E3-FADH
2
E2-L
S
S
E2-L
SH
S
H
E3-FAD
E3 =
E3 =
Dihydrolipoamide
Dihydrolipoamide
deshydrog
deshydrogé
énase
nase
NAD
+
NADH + H
+
CH
2
CH
2
CO-COO
-
COO
-
CH
2
CH
2
-CO
COO
-
CH
2
COO
-
CH
2
CH
2
CHOH TDP-E1
COO
-
Succinyl
Succinyl-
-CoA
CoA
!
!!!
!
!!!-
-C
Cé
étoglu
toglu
CoA
CH
2
CH
2
COO
-
CS
O
5
5°
°-
-Formation du
Formation du succinate
succinate
CH
2
CH
2
COO
-
COO
-
+
HSCoA
Succinyl
Succinyl-
-CoA
CoA synth
synthé
étase
tase
Compos
Composé
éinterm
intermé
édiaire
diaire succinyl
succinyl phosphate
phosphate
GDP + Pi GTP
Succinate
Succinate
ADP
ATP
Succinyl
Succinyl-
-CoA
CoA
6- Oxydation en furamate
Transformation du succinate en fumarate.
être de 2H+ et de deux électrons pour donner une double liaison.
la coenzyme qui récupère H+ et électron est le FAD, transformé par le FADH2.
Enzyme : succinase déshydrogénase, associé au transfert des électrons dans la
membrane mitochondriale interne. Rattaché à la chaine respiratoire.
Réaction inhibé par le malonate (homologue inférieur du succinate)
Les dicarboxyliques : OMSG.
3
6
6°
°-
-Oxydation en fumarate
Oxydation en fumarate
CH
2
CH
2
COO
-
COO
-
FAD FADH
2
CH
CH
COO
-
-
OOC
Succinate
Succinate deshydrog
deshydrogé
énase
nase
(associ
(associé
ée
e à
àla cha
la chaî
îne de
ne de tranfert
tranfert
des
des é
édans la MMI)
dans la MMI)
Réaction inhibée par le malonate (hom. inférieur du succinate)
7
7°
°-
-Formation du
Formation du malate
malate
CH
CH
COO
-
-
OOC
H
2
O
CHOH COO
-
CH
2
COO
-
Fumarate
Fumarate Malate
Malate
Fumarase
Fumarase
Fumarate
Fumarate
Succinate
Succinate
8
8°
°-
-Oxydation en
Oxydation en oxaloac
oxaloacé
étate
tate
CHOH
CH
2
COO
-
COO
-
Malate
Malate deshydrog
deshydrogé
énase
nase
Le cycle est bouclé !
Remarque: les 3 dernières réactions (oxydation d’un C interne)
se retrouvent aussi au niveau de la !
!!!-oxydation.
NAD
+
NADH + H
+
CCOO
-
CH
2
COO
-
O
"
"""G
0’
= + 29,7 kJ/mol mais la réaction est favorisée par l’utilisation des produits
[OA] < 10
-6
M
Malate
Malate Oxaloac
Oxaloacé
étate
tate
Oxydation d
Oxydation d’
’un
un acyl
acyl-
-CoA
CoA
RCH
2
CH
2
CH
2
C S CoA
O
Acyl-CoA
FAD
FADH
2
Acyl
Acyl-
-CoA
CoA
deshydrog
deshydrogé
énase
nase
a)
a)
b)
b)
RCH
2
C C C S CoA
O
H
HH
2
O
"
"""
"
"""2
2-
-Enoyl
Enoyl-
-CoA
CoA
hydratase
hydratase
"
"""
"
"""2
2-
-Enoyl
Enoyl-
-CoA
CoA
2
21
1
RCH
2
CSCoA
O
d)
d)
CH
2
C
O
3
3-
-c
cé
éto
to-
-acyl
acyl-
-CoA
CoA
RCH
2
C C C S CoA
O
H
HH
OH
3
32
21
1
NAD
+
NADH + H
+
L-3-OH-acyl-CoA
L
L-
-3
3-
-OH
OH-
-acyl
acyl
CoA
CoA-
-deshydrog
deshydrogé
énase
nase
c)
c)
H
2
O
"
"""
"
"""2
2-
-Enoyl
Enoyl-
-CoA
CoA
hydratase
hydratase
7- Formation du malate
!
Réaction d'hydratation
On aboutit au malate, par fixation d'une molécule d'eau.
Enzyme : fumarase.
3
6
6°
°-
-Oxydation en fumarate
Oxydation en fumarate
CH
2
CH
2
COO
-
COO
-
FAD FADH
2
CH
CH
COO
-
-
OOC
Succinate
Succinate deshydrog
deshydrogé
énase
nase
(associ
(associé
ée
e à
àla cha
la chaî
îne de
ne de tranfert
tranfert
des
des é
édans la MMI)
dans la MMI)
Réaction inhibée par le malonate (hom. inférieur du succinate)
7
7°
°-
-Formation du
Formation du malate
malate
CH
CH
COO
-
-
OOC
H
2
O
CHOH COO
-
CH
2
COO
-
Fumarate
Fumarate Malate
Malate
Fumarase
Fumarase
Fumarate
Fumarate
Succinate
Succinate
8
8°
°-
-Oxydation en
Oxydation en oxaloac
oxaloacé
étate
tate
CHOH
CH
2
COO
-
COO
-
Malate
Malate deshydrog
deshydrogé
énase
nase
Le cycle est bouclé !
Remarque: les 3 dernières réactions (oxydation d’un C interne)
se retrouvent aussi au niveau de la !
!!!-oxydation.
NAD
+
NADH + H
+
CCOO
-
CH
2
COO
-
O
"
"""G
0’
= + 29,7 kJ/mol mais la réaction est favorisée par l’utilisation des produits
[OA] < 10
-6
M
Malate
Malate Oxaloac
Oxaloacé
étate
tate
Oxydation d
Oxydation d’
’un
un acyl
acyl-
-CoA
CoA
RCH
2
CH
2
CH
2
C S CoA
O
Acyl-CoA
FAD
FADH
2
Acyl
Acyl-
-CoA
CoA
deshydrog
deshydrogé
énase
nase
a)
a)
b)
b)
RCH
2
C C C S CoA
O
H
HH
2
O
"
"""
"
"""2
2-
-Enoyl
Enoyl-
-CoA
CoA
hydratase
hydratase
"
"""
"
"""2
2-
-Enoyl
Enoyl-
-CoA
CoA
2
21
1
RCH
2
CSCoA
O
d)
d)
CH
2
C
O
3
3-
-c
cé
éto
to-
-acyl
acyl-
-CoA
CoA
RCH
2
C C C S CoA
O
H
HH
OH
3
32
21
1
NAD
+
NADH + H
+
L-3-OH-acyl-CoA
L
L-
-3
3-
-OH
OH-
-acyl
acyl
CoA
CoA-
-deshydrog
deshydrogé
énase
nase
c)
c)
H
2
O
"
"""
"
"""2
2-
-Enoyl
Enoyl-
-CoA
CoA
hydratase
hydratase
8- Oxydation en oxaloacétate
Enzyme : malate déshydrogénase qui fonctionne avec le NAD+.
La cycle est bouclé
Ici delta G0' est fortement > 0, a priori la réaction est réversible.
En réalité, L'oxaloacétate est continuellement utilisé et pompé par la première étape du
cycle. Donc il est rapidement consommé. La concentration en oxaloacétate est très faible.
Si on regarde le signe de delta G on se situe a une valeur proche de 0, la réaction se situe
a l'équilibre et comme l'oxaloacétate est constamment consommé on se situe dans le sens
de la synthèse de l'oxaloacétate ici. Deux produits : lʼoxaloacétate et le NADH qui sont très
fortement consommés (réoxydés). Deux produits finaux à lʼétat dʼéquilibre, en
concentration très faible.

Les 3 dernières réactions se situent au niveau de la béta oxydation.
3
6
6°
°-
-Oxydation en fumarate
Oxydation en fumarate
CH
2
CH
2
COO
-
COO
-
FAD FADH
2
CH
CH
COO
-
-
OOC
Succinate
Succinate deshydrog
deshydrogé
énase
nase
(associ
(associé
ée
e à
àla cha
la chaî
îne de
ne de tranfert
tranfert
des
des é
édans la MMI)
dans la MMI)
Réaction inhibée par le malonate (hom. inférieur du succinate)
7
7°
°-
-Formation du
Formation du malate
malate
CH
CH
COO
-
-
OOC
H
2
O
CHOH COO
-
CH
2
COO
-
Fumarate
Fumarate Malate
Malate
Fumarase
Fumarase
Fumarate
Fumarate
Succinate
Succinate
8
8°
°-
-Oxydation en
Oxydation en oxaloac
oxaloacé
étate
tate
CHOH
CH
2
COO
-
COO
-
Malate
Malate deshydrog
deshydrogé
énase
nase
Le cycle est bouclé !
Remarque: les 3 dernières réactions (oxydation d’un C interne)
se retrouvent aussi au niveau de la !
!!!-oxydation.
NAD
+
NADH + H
+
CCOO
-
CH
2
COO
-
O
"
"""G
0’
= + 29,7 kJ/mol mais la réaction est favorisée par l’utilisation des produits
[OA] < 10
-6
M
Malate
Malate Oxaloac
Oxaloacé
étate
tate
Oxydation d
Oxydation d’
’un
un acyl
acyl-
-CoA
CoA
RCH
2
CH
2
CH
2
C S CoA
O
Acyl-CoA
FAD
FADH
2
Acyl
Acyl-
-CoA
CoA
deshydrog
deshydrogé
énase
nase
a)
a)
b)
b)
RCH
2
C C C S CoA
O
H
HH
2
O
"
"""
"
"""2
2-
-Enoyl
Enoyl-
-CoA
CoA
hydratase
hydratase
"
"""
"
"""2
2-
-Enoyl
Enoyl-
-CoA
CoA
2
21
1
RCH
2
CSCoA
O
d)
d)
CH
2
C
O
3
3-
-c
cé
éto
to-
-acyl
acyl-
-CoA
CoA
RCH
2
C C C S CoA
O
H
HH
OH
3
32
21
1
NAD
+
NADH + H
+
L-3-OH-acyl-CoA
L
L-
-3
3-
-OH
OH-
-acyl
acyl
CoA
CoA-
-deshydrog
deshydrogé
énase
nase
c)
c)
H
2
O
"
"""
"
"""2
2-
-Enoyl
Enoyl-
-CoA
CoA
hydratase
hydratase
3
6
6°
°-
-Oxydation en fumarate
Oxydation en fumarate
CH
2
CH
2
COO
-
COO
-
FAD FADH
2
CH
CH
COO
-
-
OOC
Succinate
Succinate deshydrog
deshydrogé
énase
nase
(associ
(associé
ée
e à
àla cha
la chaî
îne de
ne de tranfert
tranfert
des
des é
édans la MMI)
dans la MMI)
Réaction inhibée par le malonate (hom. inférieur du succinate)
7
7°
°-
-Formation du
Formation du malate
malate
CH
CH
COO
-
-
OOC
H
2
O
CHOH COO
-
CH
2
COO
-
Fumarate
Fumarate Malate
Malate
Fumarase
Fumarase
Fumarate
Fumarate
Succinate
Succinate
8
8°
°-
-Oxydation en
Oxydation en oxaloac
oxaloacé
étate
tate
CHOH
CH
2
COO
-
COO
-
Malate
Malate deshydrog
deshydrogé
énase
nase
Le cycle est bouclé !
Remarque: les 3 dernières réactions (oxydation d’un C interne)
se retrouvent aussi au niveau de la !
!!!-oxydation.
NAD
+
NADH + H
+
CCOO
-
CH
2
COO
-
O
"
"""G
0’
= + 29,7 kJ/mol mais la réaction est favorisée par l’utilisation des produits
[OA] < 10
-6
M
Malate
Malate Oxaloac
Oxaloacé
étate
tate
Oxydation d
Oxydation d’
’un
un acyl
acyl-
-CoA
CoA
RCH
2
CH
2
CH
2
C S CoA
O
Acyl-CoA
FAD
FADH
2
Acyl
Acyl-
-CoA
CoA
deshydrog
deshydrogé
énase
nase
a)
a)
b)
b)
RCH
2
C C C S CoA
O
H
HH
2
O
"
"""
"
"""2
2-
-Enoyl
Enoyl-
-CoA
CoA
hydratase
hydratase
"
"""
"
"""2
2-
-Enoyl
Enoyl-
-CoA
CoA
2
21
1
RCH
2
CSCoA
O
d)
d)
CH
2
C
O
3
3-
-c
cé
éto
to-
-acyl
acyl-
-CoA
CoA
RCH
2
C C C S CoA
O
H
HH
OH
3
32
21
1
NAD
+
NADH + H
+
L-3-OH-acyl-CoA
L
L-
-3
3-
-OH
OH-
-acyl
acyl
CoA
CoA-
-deshydrog
deshydrogé
énase
nase
c)
c)
H
2
O
"
"""
"
"""2
2-
-Enoyl
Enoyl-
-CoA
CoA
hydratase
hydratase
3
6
6°
°-
-Oxydation en fumarate
Oxydation en fumarate
CH
2
CH
2
COO
-
COO
-
FAD FADH
2
CH
CH
COO
-
-
OOC
Succinate
Succinate deshydrog
deshydrogé
énase
nase
(associ
(associé
ée
e à
àla cha
la chaî
îne de
ne de tranfert
tranfert
des
des é
édans la MMI)
dans la MMI)
Réaction inhibée par le malonate (hom. inférieur du succinate)
7
7°
°-
-Formation du
Formation du malate
malate
CH
CH
COO
-
-
OOC
H
2
O
CHOH COO
-
CH
2
COO
-
Fumarate
Fumarate Malate
Malate
Fumarase
Fumarase
Fumarate
Fumarate
Succinate
Succinate
8
8°
°-
-Oxydation en
Oxydation en oxaloac
oxaloacé
étate
tate
CHOH
CH
2
COO
-
COO
-
Malate
Malate deshydrog
deshydrogé
énase
nase
Le cycle est bouclé !
Remarque: les 3 dernières réactions (oxydation d’un C interne)
se retrouvent aussi au niveau de la !
!!!-oxydation.
NAD
+
NADH + H
+
CCOO
-
CH
2
COO
-
O
"
"""G
0’
= + 29,7 kJ/mol mais la réaction est favorisée par l’utilisation des produits
[OA] < 10
-6
M
Malate
Malate Oxaloac
Oxaloacé
étate
tate
Oxydation d
Oxydation d’
’un
un acyl
acyl-
-CoA
CoA
RCH
2
CH
2
CH
2
C S CoA
O
Acyl-CoA
FAD
FADH
2
Acyl
Acyl-
-CoA
CoA
deshydrog
deshydrogé
énase
nase
a)
a)
b)
b)
RCH
2
C C C S CoA
O
H
HH
2
O
"
"""
"
"""2
2-
-Enoyl
Enoyl-
-CoA
CoA
hydratase
hydratase
"
"""
"
"""2
2-
-Enoyl
Enoyl-
-CoA
CoA
2
21
1
RCH
2
CSCoA
O
d)
d)
CH
2
C
O
3
3-
-c
cé
éto
to-
-acyl
acyl-
-CoA
CoA
RCH
2
C C C S CoA
O
H
HH
OH
3
32
21
1
NAD
+
NADH + H
+
L-3-OH-acyl-CoA
L
L-
-3
3-
-OH
OH-
-acyl
acyl
CoA
CoA-
-deshydrog
deshydrogé
énase
nase
c)
c)
H
2
O
"
"""
"
"""2
2-
-Enoyl
Enoyl-
-CoA
CoA
hydratase
hydratase
La premiere étape dʼoxydation fonctionne avec le FAD et la deuxième avec le NAD.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
1
/
11
100%