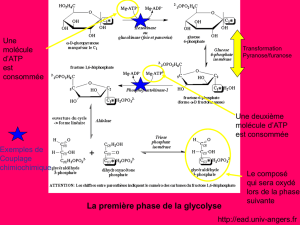
DST 1 - Techniques Spectrales Module A

T.A.S.S. 2BIO 4/11/2010
ETSL, 95 rue du Dessous – des – Berges, 75 013 PARIS 1/2
DST 1 - Techniques Spectrales
Module A
(1h00)
Documents non autorisés - Calculatrice autorisée
Justifier les calculs
Séparer calcul littéral et numérique
Questions de cours : (8 points)
1/ Nous disposons d’une solution d’acide chlorhydrique à 1 mol.L-1. Comment procéder pour
réaliser une solution diluée au 1/5ème ?
2/ Quel modèle physique utilise-t-on pour expliquer les phénomènes d’absorption ou
d’émission d’énergie rayonnante ?
3/ Pour comprendre les interactions entre rayonnement et matière, on admet que le
rayonnement électromagnétique est constitué de photons dont l’énergie est donnée par la
relation de Planck.
- a - Rappeler les différentes expressions de la relation de Planck.
- b - Calculer l’énergie E en J d’un photon de longueur d’onde λ = 5000 nm.
On donne c = 3,00.108 m.s-1 et h = 6,63.10-34 J.s.
- c - Convertir la longueur d’onde précédente en nombre d’onde σ exprimé en cm-1.
Indiquer alors à quel domaine du rayonnement électromagnétique appartient cette
longueur d’onde.
4/ Les molécules subissent 3 types de transitions quantifiées lorsqu’elles sont excitées par un
rayonnement. Préciser le nom de ces transitions et indiquer pourquoi il y a 3 types de
transitions possibles.
5/ Parmi les rayonnements lumineux, UV, Visible et IR, indiquer celui qui est le plus
énergétique. Justifier.
Exercice 1 : (4 points)
L’adénine (M = 135 g.mol-1) a un coefficient d’absorption molaire ε = 1,32.104 L.mol-1.cm-1 à
265 nm. Nous considérons que la loi de Beer-Lambert est valide dans les conditions de
l’exercice.
1/ Exprimer le coefficient d’absorption molaire en unité SI.

T.A.S.S. 2BIO 4/11/2010
ETSL, 95 rue du Dessous – des – Berges, 75 013 PARIS 2/2
2/ Calculer l’absorbance d’une solution contenant 5,5 mg d’adénine par litre placée dans une
cuve dont le trajet optique est 1 cm. (Indiquer explicitement la loi utilisée).
3/ Faire le même calcul avec une cuve dont le trajet optique est de 2 cm.
4/ Calculer la concentration massique d’une solution d’adénine présentant dans une cube de
longueur b = 1 cm de trajet optique, une absorbance de 0,650.
On donne la masse molaire de l’adénine : M = 135 g.mol-1.
Exercice 2 : (8 points)
L'absorbance dans une cuvette de 1 cm d'une solution contenant du NAD+ et du NADH est de
0,21 à 340 nm et de 0,85 à 260 nm. Les coefficients d’absorption du NAD+ et du NADH sont
identiques à 260 nm et égaux à 1,8.107 cm².mol-1. Le NADH a un coefficient d’absorption de
6,22.106 cm².mol-1 à 340 nm. Le NAD+ n’absorbe pas à 340 nm.
1/ Calculer les concentrations respectives de NAD+ et de NADH dans la solution.
2/ On mélange 1 volume de cette solution à 1 volume égal d'une autre solution à 15 µmol.L-1
de pyruvate et de la lactate déshydrogénase en excès. On suppose que la réaction :
pyruvate + NADH → lactate + NAD+
catalysée par cette enzyme est totale.
Calculer en fin de réaction les absorbances à 340 et 260 nm dans une cuve de 0,5 cm
(on supposera qu'aucune autre substance que NAD+ et NADH n'absorbe aux longueurs d'onde
considérées).
1
/
2
100%