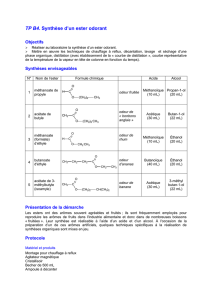
425 acetate d ethyle sept2007

Expérience 425
425 - 1 -
A) Synthèse de l'acétate d'éthyle.
B) Analyse du produit obtenu.
BUT : Préparer de l'acétate d'éthyle par estérification
METHODE UTILISEE
Réaction générale :
Estérification
ACIDE + ALCOOL ESTER + EAU
Hydrolyse
Réaction de préparation de l'acétate d'éthyle :
CH
3
COOH
+
CH
3
CH
2
OH H
2
SO
4
CH
3
+
H
2
O
CH
2
OC CH
3
O
Mécanisme réactionnel :
CH
3
C OH
O
CH
3
C OH
OH
CH
3
C OH
OH
+
..
..
C
2
H
5
O H C
2
H
5
O H
..
+
1 2 3
5
H
+
-H
+
CH
3
C OH
OH
OC
2
H
5
:..
+
H
+
CH
3
C O
OH
OC
2
H
5
H
H
4
-H
2
O
CH
3
C
OH
OC
2
H
5
+
CH
3
C O
O
C
2
H
5
-H
+
6
Etapes: 1) Catalyse acide: protonation réversible du groupe carbonyle de l'acide.
2) Addition nucléophile de l'alcool à l'acide protoné : formation de la nouvelle liaison C
-
O
3) et 4) Equilibres dans lesquels un proton passe d'un oxygène à l'autre.
5) Perte d'eau : rupture d'une liaison carbone - oxygène.
6) Régénération du catalyseur : départ d'un proton.

425 - 2 -
PRODUITS : - acide éthanoïque (acétique) concentré à ~ 99,5 %.
- acide sulfurique concentré à ~ 98 %.
- carbonate de disodium (solution 1 M).
- dichlorure de calcium (solution 1 M).
- dichlorure de calcium (grains).
- éthanol.
APPAREILLAGE : - ampoule à décanter (lavages).
- appareillage de distillation.
- ballon de réaction.
- chauffage (calotte).
- pierres à ébullition.
- récipients de récupération du produit fabriqué.
- réfrigérant.
3. Lavages
→
2. 1
ère
Distillation
↓
(sur résidu)
0
10
←
1. Reflux
4. 2
ème
Distillation
↓
(purification)

425- 3 -
A) Synthèse de l'acétate d'éthyle.
MANIPULATIONS
a) Formation de l'ester. a) Compléter le tableau ci-dessous avec l'aide du Handbook :
1. Introduire dans le ballon : - quelques pierres à ébullition.
- 5 ml d'éthanol (cylindre gradué 5 ml). Réactifs Point d'ébullition ( b.p [
0
C] )
Gants et lunettes ! - 6 ml acide acétique concentré à ~99,5% (cyl. grad. 10 ml)
Gants et lunettes ! - 1 ml acide sulfurique concentré à ~98% (cyl. grad. 5 ml)
2. Fermer le ballon avec le réfrigérant. Chauffer à reflux selon les indications pendant 10 minutes. Ethanol
A la fin des 10 minutes laisser refroidir un peu. (Abaisser la calotte chauffante et positionner
le variac sur "distillation 1"). Acide acétique
b) Distillation de l'ester (élimination du résidu).
3. Distiller sans dépasser le point d'ébullition de l'ester. Un résidu doit rester dans le ballon.
A la fin de la distillation, abaisser la calotte chauffante et positionner le variac sur "distillation 2"
*Acétate d'éthyle
théorique:
pratique:
* Chercher sous acétique acide ethyl ester : le b.p et le n
D
(indice de
c) Neutralisation et élimination des sels ioniques par lavages. réfraction).Reporter ces valeurs page 25.4
4. Transférer le distillat dans une ampoule à décanter de 50 ml. Ajouter 10 ml de carbonate 4. Donner l'équation de la réaction de neutralisation des H
+
(de H
2
SO
4
)
de disodium 1 M. par le carbonate de disodium:
Dégazer, agiter, dégazer, décanter. Eliminer la phase aqueuse. .............................................................................................................
d) Elimination de l'alcool.
5. Ajouter dans l'ampoule 10 ml de dichlorure de calcium 1 M. Dégazer, agiter, dégazer, décanter
et éliminer la phase acqueuse.
e) Elimination de l'eau (déshydratation).
6. Introduire dans l'ampoule quelques grains de dichlorure de calcium. Agiter doucement et
laisser reposer ~ 3 minutes.
En attendant, prérégler le variac pour la deuxième distillation selon les indications.
f) Distillation de l'ester (purification).
7. Transférer l'ester dans le deuxième appareil à distiller. Distiller lentement. Noter le point d'ébullition pratique de l'ester observé lors de cette distillation. Reporter page 25.4
Recueillir la première fraction. Ne pas distiller à sec! Un résidu doit rester dans le ballon.

425- 4 -
MANIPULATIONS (suite)
B) Analyse de l'ester fabriqué.
TESTS Manipulations Références Analyses
Ester Test de mise en évidence de l'ester :
Introduire dans une éprouvette: - 1 goutte de l'ester à analyser
- 1 ml solution alcooliquechlorhydrate d'hydroxylamine 0,5 M (pipette plastique).
- 4 gouttes d'hydroxyde de sodium 6 M.
chauffer à ébullition (foehn sous chapelle), laisser refroidir et ajouter :
- 2 ml d'acide chlorhydrique 1 M. Si la solution est trouble, ajouter encore 2 ml d'éthanol.
- 1 goutte d'une solution de chlorure ferrique 5 %. Si la coloration ne persiste pas, rajouter quelques gouttes.
Un test positif donne une coloration rouge violacé.
CHIMIQUE Equation de la réaction :
CH
3
C O CH
2
CH
3
+ H
2
NOH
O
CH
3
CNHOH + CH
3
CH
2
OH
O
éthanoate d'éthyle hydroxylamine
3 CH
3
CNHOH + FeCl
3
O
CH
3
CNHO Fe + 3 HCl
O
3
coloration rouge violacée
Identification / pureté : théorique pratique
PHYSIQUE - Mesurer l'indice de réfraction avec le réfractomètre et comparer avec la valeur théorique (* Handbook). n
D
- Reporter les valeurs du tableau précédant page 25.3. b.p

425- 5 -
QUESTIONNAIRE
Donner les produits de départ et les mécanisme de réactions d'estérification permettant la fabrication du benzoate de méthyle.
1
/
5
100%