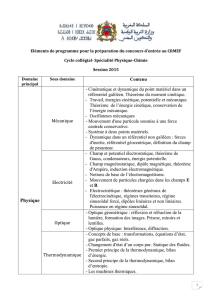
Semaine du 23/05 : cinétique et thermodynamique Une liste

Semaine du 23/05 : cinétique et thermodynamique
Une liste non limitative des notions sur lesquelles il faut réfléchir et être capable de parler un
peu, sans que ça soit forcément sous la forme d’une question de cours construite.
Cinétique
Cinétique formelle
• Réaction « lente »
• Méthodes expérimentales d’étude
• Vitesse de réaction, vitesse d’apparition, de disparition
• Loi de vitesse, constante de vitesse, ordres (global, partiels, courant, initial…)
• Méthodes de détermination de l’ordre (des ordres) et de la constante de vitesse d’une
réaction
• Catalyse
• Énergie d’activation (relation avec la thermodynamique) : aspects microscopique et
macroscopique
• Cas des réactions rapides : méthodes expérimentales et traitement des résultats
• En système ouvert : flux entrants, flux sortants, régime stationnaire
Mécanismes
• Étapes élémentaires
• Intermédiaires réactionnels, états de transition, diagramme énergétique
• Ce qui change avec la catalyse
• Pourquoi étudier le mécanisme, quelles sont les preuves expérimentales de la validité du
mécanisme
• Étape cinétiquement déterminante
• Réaction en chaîne, réaction par stades
• Approximation de l’état quasi-stationnaire
Cinétique / thermo
• Énergie d’activation
• Postulat de Hammond
• Réaction « facile » : thermo ou cinétique ?
• Rendement cinétique
• Contrôle thermodynamique ou cinétique
Thermo
Premier principe
• Enthalpie de réaction, énergie interne de réaction
• Cycle thermochimique
• Mesure expérimentale d’une enthalpie de réaction

Semaine du 23/05 : cinétique et thermodynamique
Deuxième principe
• Critère d’évolution
• Équilibre chimique
• Entropie, enthalpie libre, énergie libre de réaction
• Variance, facteurs d’équilibre
• Lois du déplacement des équilibres
Potentiel chimique
• Grandeur molaire partielle associée à G
• Expression dans les différents cas, influence des paramètres physiques
• État standard, grandeurs standard de réaction
Binaires
• Signification des lignes et des domaines
• Composition et quantité des phases en présence, théorème des moments et limites de son
emploi
• Équation des frontières (suppose l’utilisation d’un modèle pour le comportement des
différentes phases)

Semaine du 23/05 : cinétique et thermodynamique
Exercice 1 : cinétique formelle
Bromation de l’acétone en milieu acide :
On mélange des solutions aqueuses d’acétone, de dibrome et d’acide sulfurique. La
concentration du dibrome est très inférieure à celles de l’acide et de l’acétone. Pour différents
mélanges, on mesure la concentration du dibrome au cours du temps et on représente
graphiquement les résultats.
Concentrations initiales pour chaque courbe
(mol/L)
Déterminer l’ordre de la réaction par rapport à
chacun de ses réactifs.
Exercice 2 : cinétique mécanismes
Formation du bromure d’hydrogène
MBrMBrBr
HBrHHBr
BrHBrBrH
HHBrHBr
Br2Br
*
2
2
2
2
2
5
4
3
2
1
+→++
+→+
+→+
+→+
→
••
••
••
••
•
k
k
k
k
k
Par stades ou en chaîne ?
Comment réaliser la première étape ?
Établir la loi de vitesse et discuter les ordres par rapport aux différents corps.
acétone acide sulfurique
I 0,69 0,20
II 0,69 0,20
III 0,69 0,20
IV 0,69 0,10
V 0,069 0,20
1
/
3
100%