La physiologie de la douleur

La physiologie de la douleur
Hélène Batoz
MAR en anesthésie pédiatrique
SAR III

Introduction
• Douleur ≠nociception
• Nociception
– Terme employé par Sherrington au début du siècle
– caractérise un stimulus dont l'intensité entraîne des réactions de
défense visant à sauvegarder l'intégrité de l'organisme
– Ne fait pas intervenir la nature consciente de la douleur
• Ex: rôle nociceptif de l’AG en bloquant les réactions douloureuses
peropératoires
• La douleur (définition de l’IASP)
– « une sensation désagréable associée à une expérience
émotionnelle en réponse à une lésion tissulaire réelle ou
potentielle, ou décrite en des termes signifiant une telle lésion »
– Multiples composantes
• Motrices, verbales, végétatives, sensori-discriminatives, cognitives..

Introduction
• Certains auteurs divisent la douleur en 2
catégories
– Douleur « adaptée » (« adaptative » en anglo-saxon)
• contribue à la survie par le signal d'alarme qu'elle procure
• Finalité: déclencher des réactions qui visent à diminuer la
cause et par suite de limiter les conséquences
• Déclenchée par des douleurs intenses (> seuil nociceptif)
– Douleur « inadaptée » (« maladaptative » en anglo-
saxon)
• expression d'un processus pathologique du système nerveux
• concerne les trois types de douleurs: inflammatoire,
neuropathique et fonctionnelle (mécanismes qui peuvent être
communs)
• Caractérisée par une modification dans la sensibilité aux
stimuli (allodynie, hyperalgésie..)
Conséquence de phénomènes de sensibilisation +++

Introduction
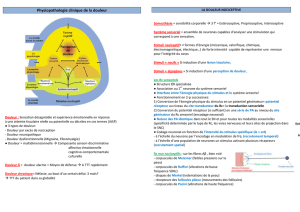
• La douleur aiguë
– Secondaire à une stimulation au niveau des nocicepteurs
périphériques
• Chirurgie, trauma, maladies aiguës, soins,
explorations…
• Stimulation de forte intensité
– Douleur neuropathique : liée à une lésion du SN
– Douleur idiopathique
– Douleur psychogène
• Phénomène d’allodynie
– Douleur produite par un stimulus non nociceptif
• Phénomène d’hyperalgésie
– Sensibilité accrue à un stimulus nociceptif
Font également partie du champ d’étude de la physiologie de la perception douloureuse

Introduction
• La douleur aiguë
– Processus physiologique « d’alarme »
• Avertit sujet qu’un stimulus « nociceptif » menace intégrité
physique
• Mise en jeu de mécanismes de défense
– localisation et mesure intensité du stimulus (caractère sensori-
discriminatif)
– Composante affective, cognitive (modification de l’attention,
anticipation, mémorisation)
– Réactions motrices, verbales, végétatives (tachycardie, HTA…)
– Dérèglement de ce système nociceptif
• Excès de nociception ou lésion neurologique sur voies
nociceptives
• Facteurs neurophysiologiques, psychologiques,
comportementaux et sociaux
Transformation du Sp initial « douleur aiguë » en douleur chronique
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
1
/
44
100%