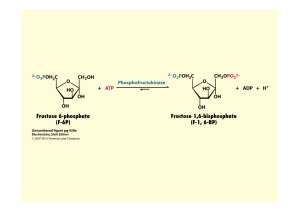
Le fructose-2, 6-bisphosphate chez les mammifères - iPubli

SYNTHÈSE
1987 ; 3: 568-73
Louis Hue
Mark H. Rider
L


et
1

3
3

 6
6
1
/
6
100%