corrigé du bac blanc 2016 exercice a : les débuts de l`électron en

1/4
CORRIGÉ DU BAC BLANC 2016
EXERCICE A : LES DÉBUTS DE L’ÉLECTRON EN PHYSIQUE (9 POINTS)
1.
L'
EXPÉRIENCE DE
J.J.
T
HOMSON
1.1. Le champ électrique
E
dans un condensateur plan est perpendiculaire aux armatures.
La force électrique
e
F q.E e.E
= = −
a donc même direction.
L'électron est dévié vers le haut donc la force électrique
e
F
est orientée de P
2
vers P
1
.
Le champ électrique a un sens opposé car
e
F e.E
= −
donc orienté de P
1
vers P
2
.
1.2. Système : électron
Référentiel : terrestre considéré galiléen
Bilan des forces extérieures : force électrostatique
e
F e.E
= −
2
ème
loi de Newton :
ext e
F m .a
Σ =
soit :
e
e.E m .a
− =
d'où :
e
e.E
a
m
−
=
x x
y
y y
e e
a 0 dv / dt
e.E
ae.E
a dv / dt
m m
= =
−
= = =
d'où par intégration :
x 1
y 2
e
v C
ve.E
v .t C
m
=
= +
or :
( )
0x 0 1
0y 2
v v C
v 0s
v 0 C
= =
= =
x 0
ye
v v dx / dt
ve.E
v .t dy / dt
m
= =
= =
d'où par intégration :
0 3
2
4
e
x v .t C
OM e.E
y t C
2.m
= +
= +
or :
(
)
OM 0s 0
=
donc C
3
= C
4
= 0
0
2
e
(1)
x v .t
OM e.E
y t
(2)
2.m
=
=
1.3.
(1) donne :
0
x
t
v
=
d'où en remplaçant dans (2) :
2
2
e 0
e.E
y .x (3)
2.m .v
=
1.4.
Le point S appartient à la trajectoire : ses coordonnées
(
)
S
L,y
vérifient l'équation (3) :
2
S2
e 0
e.E
y .L
2.m .v
=
⇔
2 2
e 0 S
2.m .v .y e.E.L
=
⇔
(
)
( )
2
7 2
2
11 1
0 S
2 2
3 2
e
2 2,27.10 1,85.10
2.v .y
e
1,76.10 C.kg
mE.L 15,0.10 8,50.10
−
−
−
× ×
= = =
×
Avec les valeurs de l'énoncé :
19
11 1
31
e
e 1,602176565.10
1,7588201.10 C.kg
m 9,1093826.10
−
−
−
= =
Il y a donc un bon accord avec les valeurs actuellement admises.
1.5.
2 2 2 2
11 9 1
e 0,05 0,1 0,02 0,05
U 1,76.10 4 4 6,1.10 C.kg
m 1,85 15,0 2,27 8,50
−
= + + + =
On ne garde qu'un CS pour l'incertitude en la majorant : U(e/m) = 7.10
9
C.kg
–1
= 0,07.10
11
C.kg
–1
donc :
11 –1
e / m (1,76 0,07).10 C.kg
= ±
1.6.
Calculons le rapport suivant :
3
11 14
e
e e e
Fe.E e E 15,0.10
. 1,76.10 2,7.10 1
P m .g m g 9,8
= = = =
≫
Le poids de l'électron est donc bien négligeable devant la force électrostatique.
2.
L'
EXPÉRIENCE DE
M
ILLIKAN
2.1. Chute verticale de la gouttelette
2.1.1.
Lorsque la vitesse constante v
1
est atteinte, le mouvement de la gouttelette est alors rectiligne uniforme donc d'après le
principe d'inertie (ou 1
ère
loi de Newton) :
ext
F 0
Σ =
⇔
P f 0
+ =
soit en norme : P = f
d'où :
1
6. . .r.v m.g
πη =
⇔
1
m.g
v
6. . .r
=
πη
2.1.2.
2
1
2. .g.r
v
9.
ρ
=
η
⇔
(
)
5 3
6
1
9 1,8.10 2,11.10 /10,0
9. .v
r 1,4.10 m 1,4µm
2. .g 2 890 9,8
− − −
× ×
η
= = = =
ρ × ×
2.1.3.
2
1
2. .g.r
v
9.
ρ
=
η
donc si r diminue alors v
1
diminue
⇒
il faut sélectionner une petite gouttelette.

2/4
2.2. Remontée de la gouttelette
2.2.1. Si la vitesse de descente
2
1
2. .g.r
v
9.
ρ
=
η
est la même c'est donc que le rayon est le même pour les 2 gouttelettes
considérées, les autres paramètres (ρ, g et η) restants identiques.
Comme
( )
1 2
6. . .r. v v
qE
πη +
= − alors :
2 1
q.E
v v
6. . .r
= − −
πη
Comme v
2
est différente pour les 2 gouttelettes et que v
1
et r sont identiques, cela implique des charges q différentes.
2.2.2.
Calculons le rapport |q| / e pour chaque gouttelette du tableau :
Le rapport calculé est toujours égal à un nombre entier : la charge électrique des gouttelettes est quantifiée.
2.3.
Millikan a observé des gouttelettes chargées électriquement qu’il a immobilisées en faisant varier la valeur du champ
électrique tandis que Thompson a observé la déviation d’un faisceau d’électron en maintenant la valeur du champ électrique
constante.
EXERCICE B : AUTOUR DE L'ACIDE CROTONIQUE (6 POINTS)
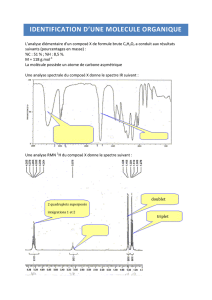
1. Détermination de la formule brute de l’acide crotonique
1.1.
( ) ( )
( )
x y z
x.M C
P C M C H O
=
⇔
( )
( )
( )
x y z
P C .M C H O 0,558 86,0
x 4,00
M C 12,0
×
= = =
De même :
( )
(
)
( )
x y z
P H .M C H O 0,070 86,0
y 6,0
M H 1,0
×
= = =
et :
( )
(
)
( )
x y z
P O .M C H O 0,372 86,0
z 2,00
M O 16,0
×
= = =
La formule brute de l'acide crotonique est bien : C
4
H
6
O
2
2. Structure de l’acide crotonique
2.1.
2.2.
2.3.
2.4.
Règle des (n+1)-uplets : un groupe de protons équivalents possédant n voisins est caractérisé par un signal avec n+1 pics.
2.5.
A
2
est l'acide 2-méthylprop-2-énoïque :
- suffixe "oïque" : c'est un acide carboxylique
- "prop" : chaine principale avec 3 atomes de carbone
- "2-én" : présence d'une double liaison C=C entre les carbones n°2 et 3 de la chaine principale
- "2-méthyl" : ramification –CH
3
portée par le carbone n°2 de la chaine principale
2.6.
Numéro
de la gouttelette Charge q de la gouttelette
(C) |q| / e
1 –6,4.10
–
19
4,0
2 –8,0.10
–
19
5,0
3 –9,6.10
–
19
6,0
4 –1,6.10
–
18
1,0
5 –9,6.10
–
19
6,0
groupe avec 3H
1 voisin donc doublet
⇒
⇒⇒
⇒ signal à 1,9ppm
groupe avec 1H
1 voisin donc doublet
⇒
⇒⇒
⇒ signal à 5,9ppm
groupe avec 1H
4 voisins donc multiplet
⇒
⇒⇒
⇒ signal à 7,1ppm
groupe avec 1H
0 voisin donc singulet
H groupe carboxyle donc δ > 8,5ppm
⇒
⇒⇒
⇒ signal à 12ppm
groupe carboxyle
A1 présente l'isomérie Z/E
A2
Z
E : acide crotonique A2
La molécule présente 4 groupes de protons équivalents : a, b, c et d.
Les deux H des groupes (a) et (b) ne sont pas équivalents car ils ne
possèdent pas le même environnement chimique : la double liaison
C=C entre les carbones n° 2 et 3 empêche la libre rotation autour de
cette liaison.
L'un (a) reste toujours plus proche du groupe méthyl,
l'autre (b) du groupe carboxyle.
(a)
(b)
(c)
(d)

3/4
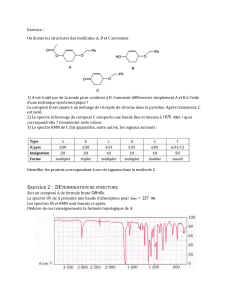
2.7. Les composés A
1
et A
2
possèdent les mêmes groupes fonctionnels donc les spectres IR auront les mêmes bandes d'absorption.
Seule la zone dite des "empreintes digitales" (σ<1500cm
–1
) sera différente d'un spectre à l'autre mais celle-ci est difficilement
exploitable.
3. Isomère de l’acide crotonique
3.1. Cette molécule appartient aux familles des alcènes et des esters.
3.2. Cf. ci-contre pour le groupe ester (alcène n'est pas un groupe fonctionnel).
3.3. La grandeur portée en abscisses du spectre IR est le nombre d'onde σ (cm
–1
).
3.4.
c .f
T
λ
= = λ ⇔
c
f
λ =
3.5.
1 1
8 2 13
m.s m
c
f c . 3,000.10 2956.10 8,868.10 Hz
− −
= = σ = × =
λ car : 1 2 1
2
1 1
1cm 10 m
1cm 10 m
− −
−
= = =
3.6.
bande (a) : σ ≈ 2950cm
–1
due à la liaison C
tetra
–H (carbone tétragonal lié à 4 atomes)
bande (b) : σ ≈ 1750cm
–1
due à la liaison C=O de l'ester
bande (c) : σ ≈ 1650cm
–1
due à la liaison C=C de l'alcène
4.
Synthèse et transformation de l’acide crotonique
4.1.
4.2.
spectre 1 : bande vers 1725cm
–1
due à la liaison C=O de l'aldéhyde
spectre 2 : bande large centrée sur 3400cm
–1
due à la liaison O–H de l'alcool
Le spectre 1 correspond à l'éthanal et le spectre 2 à l'éthanol.
4.3.
4.4.
• Le spectre RMN comporte 3 signaux donc la molécule possède 3 groupes de protons équivalents : on peut éliminer
.
• Dans la molécule
, l'atome d'hydrogène du groupe (b) possède 6 voisins : le signal associé comporte 7 pics (heptuplet).
Comme on ne retrouve pas cette multiplicité dans le spectre étudié, il ne s'agit pas de la molécule
.
• Les molécules
et
possèdent toutes les deux un singulet, un triplet et un quadruplet.
Cependant, le déplacement chimique du quadruplet du spectre étudié est plus élevé que ceux des autres signaux.
Il se situe vers 4,0ppm et correspond d'après les tables de données à des H de type –C
H
2
–O– ou –C
H
3
–O–.
Il s'agit donc de la molécule
car :
- le groupe (c) de la molécule
aurait donné un singulet et non un quadruplet comme observé sur le spectre,
- la courbe d'intégration de ce signal sur le spectre correspond à 2H comme dans la molécule
et non à 3H comme dans la
molécule
.
échelle de la courbe d'intégration : 8H ↔ 36mm donc 1H ↔ 4,5mm
quadruplet ↔ 9mm soit 2H
La molécule
a pour nom éthanoate d'éthyle.
EXERCICE C : UN LASER ET DES FILS (5 POINTS)
1.
Le phénomène de diffraction observé est caractéristique d'une
onde. La lumière a donc un aspect ondulatoire.
2.
Une lumière monochromatique est constituée d'une seule radiation
de fréquence fixée (ou de longueur d'onde dans le vide fixée).
3.
Cf. schéma ci-contre.
4.
côté opposé L / 2 L
tan
côté adjacent D 2.D
θ ≈ θ = = =
5.
m
rad m
a
λ
θ =
6.
L
a 2.D
λ
θ = =
d'où :
2. .D
La
λ
=
7.
Ainsi, plus le diamètre du fil est petit, plus la largeur de la tache centrale de diffraction est grande :
L
A
> L
B
donc a
A
< a
B
ainsi le fil calibré de diamètre a
1
= 60µm correspond à la figure A et celui de diamètre a
2
= 80µm à B.
alcène ester
éthanol
éthanal
3 groupes
3 groupes
4 groupes
3 groupes
(a)
triplet
(b)
quadruplet
singulet
(c)
(a)
singulet
(a)
(a)
quadruplet
(b) (b)
heptuplet
(b)
(c)
triplet
(
c
)
(
c
)
(
d
)

4/4
8. x = 1 / a donc :
9. Courbe L = f(x) = f(1/a) :
10. Le graphe L = f(x) est une droite qui passe par l'origine, donc la largeur L de la tache centrale est proportionnelle à l'inverse du
diamètre du fil, car x = 1/a.
L'équation modélisant la droite est de la forme :
1
L k.x k a
= = en identifiant avec la relation du
7.
:
k
2. .D 1
L 2. .D
a a
λ
= = λ
d'où :
k 2. .D= λ
11.
Coefficient directeur de la courbe :
2
1
L 64mm
k 2,6mm
x 25mm
−
∆
= = =
∆
Longueur d'onde de la lumière émise :
2
m67 2
mm
k 2,6.10 5,1.10 m 5,1.10 nm
2.D 2 2,50
−−
λ = = = =
×
12.
Les ondes diffractées par les deux fils vont se superposer et interférer sur l'écran.
L'interfrange, distance entre deux franges sombres ou deux franges brillantes, est la grandeur caractéristique de ce phénomène.
a (mm) 0,040 0,060 0,080 0,100 0,120
L (mm) 63 42 32 27 22
1
1
x (mm )
a
−
= 25 17 13 10,0 8,33
64
1
/
4
100%