Les Matrices Dermiques Acellulaires en reconstruction mammaire

UNIVERSITE PARIS-EST CRETEIL VAL DE MARNE
FACULTE DE MEDECINE DE CRETEIL
******************
ANNEE 2016 N°
Conformément aux dispositions de
l’Arrêté du 10 septembre 1990,
tient lieu de :
THESE
POUR LE DIPLOME D’ETAT DE
DOCTEUR EN MEDECINE
Discipline : Chirurgie Générale
------------
Présentée et soutenue devant le Jury Interrégional publiquement le 11 avril 2016
à la
Faculté de Médecine PARIS - DIDEROT
------------
Par
VIDALI Nelly
Née le 13 avril 1984 à Vitry-Sur-Seine
-------------
Les Matrices Dermiques Acellulaires en reconstruction
mammaire. Mise au point et Retour d'expérience de l'utilisation
du Strattice® : A propos de cinquante-deux cas
PRESIDENT DE THESE : LE CONSERVATEUR DE LA
Mr le Pr REVOL Marc BIBLIOTHEQUE UNIVERSITAIRE
DIRECTEUR DE THESE :
Mr le Dr ATLAN Michaël
Signature du Cachet de la bibliothèque
Président de thèse universitaire

2
REMERCIEMENTS
A mon Président de thèse, Monsieur le Professeur Marc REVOL.
Je tiens à vous remercier de m'avoir fait l'honneur de présider ce jury. Je n'ai pas eu
la chance d'être interne dans votre service et de bénéficier de votre enseignement.
Sans me connaître, vous acceptez de juger mon travail et soyez assuré pour cela de
ma profonde gratitude.
A mon Directeur de thèse, Monsieur le Docteur Michaël ATLAN.
Comme tu le sais, toute jeune interne, tu as suscité ma vocation pour la chirurgie
plastique. Je te suis reconnaissante pour m'avoir suivie et soutenue tout au long de
mon internat. Tes conseils et ton compagnonnage furent précieux et tu as su me
donner confiance en moi en me tirer vers le haut. Encore merci.
A Monsieur le Professeur Marc CHAOUAT.
Je souhaite vous témoigner toute ma reconnaissance pour ce semestre passé à vos
côtés. Vous êtes un exemple de rigueur, de patience, de gentillesse et d'humilité qui
sont les qualités primordiales d'un chirurgien et dont je m'inspirerai pour ma carrière
future. Ce fût une grande chance de bénéficier de votre enseignement.
A Monsieur le Docteur Jonathan RAUSKY.
Tu m'as fait l'honneur d'accepter de juger ce travail sans hésiter et je te prie de croire
en l'expression de ma gratitude. Je regrette de ne pas avoir eu la chance d'opérer
avec toi. J'espère que nous aurons un jour l'opportunité de nous croiser dans de
lointaines contrées, en Afrique ou ailleurs...

3
A mes maîtres d'internat :
Au docteur Patrick LEYDER, tout simplement merci pour votre soutien. Ce fût une
chance d'apprendre à vos côtés
Au docteur Julien QUILICHINI, qui m'a initiée à la chirurgie plastique avec beaucoup
de bienveillance. Tu aimes transmettre ton savoir et ça se ressent.
Au docteur Bruno Burin des Roziers et à ma Jojo (Johanna Zeitoun).
Aux docteurs Thierry GUIHARD et Périg LEMASURIER, "Pipo et Mario" font un site
internet, d'ailleurs l'avez vous enfin changé??!! Quel immense plaisir de vous avoir
connus, vous avez marqué une génération d'internes passée à Huguenin!
Aux docteurs Romain BOSC et Barbara HERSANT, merci pour ce super semestre,
et à toute la "Boloss team" Mondorienne :
A Diane LABROUSSE, alias Dianus , à très vite pour des randos alsaciennes!
A Ralph ABBOU, alias l'Erasmus, "mais tout ça c'est que des rumeurs " Merci pour
les tuyaux (Mulhouse!), pour tes conseils avisés, et j'espère que tu remettras malgré
tout un jour les pieds en Alsace pour venir me voir!
A Frederic PICARD, alias Picouz , le cointerne en or, toujours serviable, souriant et
droit. Tu as su me réconforter dans les périodes de "craquages" et je t'en remercie.
A Warren NOEL, alias "j'ai fait ci, j'ai fait ça", en mémoire de nos rigolades, tu as su
être là dans mes moments de doutes, merci.
A Simone LAPADULA, alias "Salmone", la main sur le coeur tout simplement, le mec
le plus souriant qui soit.
A Kim TRAN, une nouvelle vie commence pour toi, je suis heureuse de t'avoir
connue .
A Sofiane BENDIFALLAH, alias "publicator" merci pour les Stat! à bientôt j'espère
entre 2 gardes/congrès/articles/mémoires...!

4
A Chanth BALIAN, mes premiers pas au bloc furent avec toi, ton exemple a été mon
moteur pour réussir les ECN et faire chirurgie.
A mes amies de longue date et aux autres :
A Laura KELLER, rencontrée il y a plus de 10 ans sur les bancs de la fac, tu fais à
présent partie de ma vie . Ta famille s'agrandit, je te souhaite d'être heureuse.
A Ana BENTO DA COSTA, à nos années collège et lycée, à nos années médecine,
à nos voyages, à ton soutien sans faille.
A ma famille :
A mes frères et soeurs : Remy, Isabelle (qui a énormément contribué à la rédaction
de cette thèse), Agnès, Mathilde, Armel. A Aurélie Vidali.
A Papa et Maman, que je vais (enfin) bientôt quitter, il était temps!
J'espère que vous êtes fiers de moi car c'est le plus important à mes yeux.

5
TABLE DES MATIERES
1. INTRODUCTION .................................................................................................. 10
1.1. Généralités ................................................................................................... 10
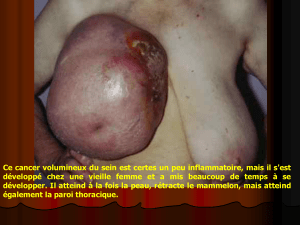
1.1.1. Cancer du sein ........................................................................................ 10
1.1.2. Rappels anatomiques .............................................................................. 11
1.2. La reconstruction prothétique .................................................................... 15
1.2.1. Prérequis ................................................................................................. 15
1.2.2. La reconstruction mammaire par prothèse .............................................. 15
1.2.3. Prothèse d'expansion tissulaire ............................................................... 16
1.2.4. Lambeau d'Avancement Abdominal ........................................................ 18
1.3. Les substituts dermiques ............................................................................ 19
1.3.1. Généralités sur les Matrices Dermiques Acellulaires ............................... 19
1.3.2. MDA disponibles en chirurgie mammaire ................................................ 24
1.4. Interdiction du Strattice® en chirurgie mammaire par l'ANSM ................ 29
2. MATERIEL ET METHODES ................................................................................ 31
2.1. Objectifs de l'étude ...................................................................................... 31
2.2. Population .................................................................................................... 31
2.3. Méthodologie ................................................................................................ 32
2.3.1. Type de mastectomie et indications ........................................................ 32
2.3.2. Technique chirurgicale ............................................................................ 33
2.3.3. Complications post-opératoires ............................................................... 37
2.3.4. Suivi post-opératoire ................................................................................ 40
2.3.5. Questionnaire de satisfaction Breast-Q ................................................... 41
2.3.6. Analyse statistique ................................................................................... 41
3. RESULTATS ........................................................................................................ 43
3.1. Description de la population ....................................................................... 43
3.1.1. Caractéristiques générales de la population étudiée ............................... 43
3.1.2. Types de cancers .................................................................................... 45
3.2. Analyse des complications ......................................................................... 46
3.3. Satisfaction des patientes / Analyse du questionnaires Breast-Q : ........ 50
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
1
/
99
100%