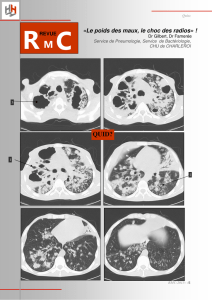
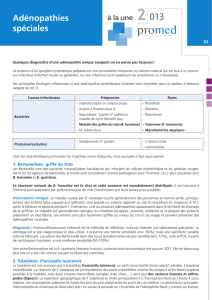
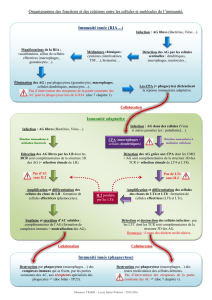
b - Université Paul Sabatier

HÈSE
En vue de l'obtention
du
DOCTORAT DE L’UNIVERSITÉ DE TOULOUSE
Délivré par l'Université Toulouse III - Paul Sabatier
Disc ipline : Mic robiologie
Présentée et soutenue par Alexandre Gouzy
Le
13/12/2013
Etude de l’utilisation des acides aminés aspartate et asparagine
dans la virulence de Mycobacterium tuberculosis
JURY
Pr. Olivier Dussurget , Institut Past eur (Paris) - Rapporteur
Dr. Alain Charbit, Université Paris Descartes (Paris) - Rapporteur
Dr. Prisc ille Brodin, Institut Pasteur (Lille) - Examinat ric e
Dr. Nic Lindley, INSA (Toulouse) - Examinateur
Dr. Ludovic T ailleux, Inst itut Pasteur (Paris) - Examinateur
Pr. Claude Gutierrez, IPBS/CNRS/UPS (Toulouse) - Président
Dr. Yannick Poquet, IPBS/CNRS/UPS (Toulouse) - Directeur de thèse
Dr. Olivier Neyrolles, IPBS/CNRS/UPS (T oulouse) - Direc teur de thèse
Ecole doctorale : Biologie - Santé - Biotec hnologies
Unité de recherche : Institut de Pharmacologie et de Biologie Structurale (UMR5089, CNRS)
Directeurs de Thèse : Olivier Neyrolles et Y annic k Poquet


1
Etude e lisation des acides aminés aspartate et asparagine
da la virulence de Mycobacterium tuberculosis
L’agent étiologique de la tuberculose est Mycobacterium tuberculosis, un pathogène intracellulaire
facultatif se développant à l’intérieur de cellules phagocytaires, notemant les macrophages
alvéolaires. Une meilleure compréhension de l’interaction entre le bacille tuberculeux et son hôte est
nécessaire pour permettre l’élaboration d’un vaccin plus protecteur que le vaccin actuel ainsi que
l’identification d’antituberculeux plus efficaces que ceux existant.
Au cours de ma thèse, je me suis intéressé aux mécanismes d’acquisition de nutriments
utilisés par la bactérie pour assurer sa croissance et résister aux mécanismes bactéricides de l’hôte.
De nombreuses études ont pu mettre en évidence que le bacille tuberculeux utilise des lipides de
l’hôte tels que les triglycérides et le cholestérol ou des glucides tel que le glucose pour se multiplier
et/ou se maintenir à l’intérieur des tissus infectés. Alors que ces substrats servent principalement de
source de carbone et d’énergie, peu de choses sont connues en ce qui concerne la nature des
molécules azotées utilisées par le bacille durant l’infection. En effet, l’azote, tout comme le carbone,
est un élément essentiel chez les êtres vivant entrant dans la composition de biomolécules
d’importance majeure telles que les acides aminés et les acides nucléiques. Mon projet de thèse
consistait donc à identifier la nature de molécules azotées acquises par le bacille durant l’infection et
dont l’utilisation serait impliquée dans la croissance du pathogène au sein des tissus.
Nous avons pu mettre en évidence que M. tuberculosis possède un transporteur unique pour
importer l’aspartate, nommé AnsP1, et que ce transporteur est requis par le pathogène pour se
multiplier in vivo chez la souris. Par des techniques de métabolomique, nous avons pu montrer que
cet acide aminé sert principalement de source d’azote à la bactérie lors de sa croissance in vitro. Ces
résultats démontrent, pour la première fois, que les acides aminés, et en particulier ici l’aspartate,
constituent une source importante d’azote permettant la croissance de Mycobacterium tuberculosis
durant l’infection (Gouzy et al, Nature Chemical Biology, publié). En parallèle de cette découverte,
nous avons pu démontrer qu’un autre transporteur homologue à AnsP1, appelé AnsP2, est quant à
lui impliqué dans l’import d’un autre acide aminé, l’asparagine. AnsP2, contrairement à AnsP1, n’est

2
pas requis pour la croissance de la bactérie chez l’animal, probablement du fait de la présence
d’autres transporteurs d’asparagine chez la bactérie. Cela dit, nous avons pu montrer que
l’asparaginase AnsA, un enzyme nécessaire à l’utilisation de l’asparagine est requis par le bacille
tuberculeux pour la colonisation de l’hôte. De façon intéressante, nous avons pu montrer que
l’asparaginase AnsA, en plus de son implication dans l’assimilation de l’azote de l’asparagine chez la
bactérie, est impliquée dans un mécanisme de résistance au stress acide, un environnement
rencontré à l’intérieur des macrophages. Cette seconde étude souligne à nouveau le lien étroit qui
existe entre le métabolisme du pathogène et ses capacités à résister aux mécanismes antimicrobiens
de l’hôte (Gouzy et al, PLOS Pathogens, en révision). Ces travaux de thèse ont permis de mettre en
évidence, pour la première fois, le rôle des acides aminés dans la nutrition et la virulence de
Mycobacterium tuberculosis et ouvrent la voie pour la recherche de nouveaux antituberculeux
permettant d’inhiber l’assimilation de ces nutriments par le pathogène au cours de l’infection.

3
ABREVIATIONS
ABC: ATP-biding-cassette
atgs : Autophagy-related genes
BCG : Bacille de Calmette et Guérin
CFP-10 : 10 kDa culture filtrate protein
CHO : Cholestérol
CE : Esters de cholestérol
CXCL1 : C-X-C motif chemokine ligand 1
CXCL10 : C-X-C motif chemokine ligand 10
DC-SIGN : Dendritic Cell-Specific Intercellular adhesion molecule-3-Grabbing Non-integrin
DIM : Phtiocérol dimycosérosates
DOTS : Directly observed therapy short course
EBP50 : Ezrin/radixin/moesin (ERM)-binding phosphoprotein 50
EEA1 : Early endosome antigen 1
ESAT-6 : 6 kDa early secretory antigenic target
ESX-1 : ESAT-6 secretion system 1
Fcr : Immunoglobulin Fc receptor
GABA : acide ɣ-aminobutyrique
GROα : Growth regulated oncogene-alpha
HLA class II : Human leucocyte antigen class II
IL : Interleukine
INFɣ : gamma interferon
iNOS : Inducible nitric oxide synthase
IRGM : Immunity-related GTPase M
Icl1/2 :Isocitrate lyase 1/2
LAM : lipoarabinomannane
LM : lipomannane
MCP-1 : Monocyte chimoattractant protein 1
MDR : Multi-drug resistant
MR : Mannose receptor
NBD : nucleotide binding domain
NdK : nuleoside diphosphate kinase
NLR: NOD-like receptor
NRAMP1: Natural resistance-associated macrophage protein 1
OMS : Organisation mondiale de la santé
ORPL1 : Oxysterol-binding protein–related protein1
PAMPs : Pathogen associated molecular pattern
PE : Phosphatidylethanolamines
PI3K : Phosphatidylinositol-3-phosphate kinase
PI3P : Phosphatidylinositol-3-phosphate
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
 107
107
 108
108
 109
109
 110
110
 111
111
 112
112
 113
113
 114
114
 115
115
 116
116
 117
117
 118
118
 119
119
 120
120
 121
121
 122
122
 123
123
 124
124
 125
125
 126
126
 127
127
 128
128
 129
129
 130
130
 131
131
 132
132
 133
133
 134
134
 135
135
 136
136
 137
137
 138
138
 139
139
 140
140
 141
141
 142
142
 143
143
 144
144
 145
145
 146
146
 147
147
 148
148
 149
149
 150
150
 151
151
 152
152
 153
153
 154
154
 155
155
 156
156
 157
157
 158
158
 159
159
 160
160
 161
161
 162
162
 163
163
 164
164
 165
165
 166
166
 167
167
 168
168
 169
169
 170
170
 171
171
 172
172
 173
173
 174
174
 175
175
1
/
175
100%