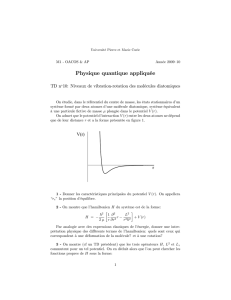
Chap. 3

Guy COLLIN 2014-12-26
LA CHIMIE
THÉORIQUE
Chapitre 3
La rotation pure

2014-12-29
La rotation pure
La molécule diatomique peut tourner sur elle-même.
Comment peut-on observer ce mouvement
moléculaire ?
Est-ce que l’application de la mécanique classique
renseigne sur les lois qui gouvernent ce mouvement ?
L’introduction de la mécanique quantique est-elle
nécessaire ?
Si oui, quelles en sont les conséquences sur les
l’interprétation des observations ?

2014-12-29
Résultats expérimentaux
•Absorption dans l’infrarouge lointain, au-delà
de 30 mm.
•Une série de raies à peu près équidistantes.
•Observations similaires dans le domaine des
hyperfréquences (région de 0,2 à 2 mm).
•En général, plus la molécule est lourde plus le
spectre se trouve dans une région de grande
longueur d’onde.

2014-12-29
Spectre électromagnétique
Domaine
d’observation
de la rotation
des molécules
Micro-ondes Infrarouge Ultraviolet Rayons X
Région du visible
longueur d’onde l(nm)
0,1
10
103
105
1010 1012 1014 1016 1018
fréquence
n
(hertz)
1 kcal/mol
1 kJ/mol
1 eV
106
104108
100
1
Énergie
n
(cm-1)

2014-12-29
Absorption de HCl gazeux
dans la région des micro-ondes
n( cm-1)
n
(cm-1)
expérimental
n
(cm-1)
Nombre
entier
n
(cm-1)
calculé
83,03
21,07
4
82,72
104,10
20,20
5
103,40
124,30
20,73
6
124,08
145,03
20,48
7
144,76
165,51
20,35
8
165,44
185,86
20,52
9
186,12
206,38
20,32
10
206,80
226,50
11
227,48
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
1
/
30
100%