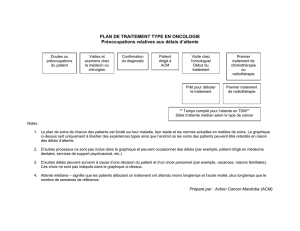
Janvier 2013

AAEIP, AUF, Université Paris-Sud
30 janvier 2013
Anticorps monoclonaux à usage thérapeutique et
immuno-surveillance des cancers
Jean-Luc Teillaud
Equipe 14 « Biotechnologie des Anticorps »,
Centre de Recherche des Cordeliers/INSERM U.872

AAEIP, AUF, Université Paris-Sud
30 janvier 2013
Les AcM utilisés en oncologie et dans le traitement des
maladies auto-immunes/inflammatoires (FDA+EMEA+ Chine)
Parmi les 27 AcM qui sont sur le marché et qui ont généré des
revenus de près de quarante cinq milliards d’Euros en 2012:
-10 AcM sont utilisés pour le traitement de maladies
inflammatoires/auto-immunes (anti-TNFalpha (4), anti-BLyS (1), anti-
CD20 (1), anti-intégrine a4 (1), anti-IL-6-R (1), anti-IL12/23 (1), anti-IL-
1beta (1)
-16 AcM sont utilisés en oncologie* (anti-CD20 (4), anti-HER2/neu (2),
anti-EGFR (3), anti-CD52 (1), anti-CD147 (1), anti-VEGF (1), anti-
Epcam (2, incluant un Ac bispécifique anti-Epcam x anti-CD3), anti-
CTLA-4 (1), anti-CCR4 (1)
* Le gemtuzumab (anti-CD33), un AcM couplé à l’ozogamycine aété retiré du marché en
2011. * Janvier 2013

AAEIP, AUF, Université Paris-Sud
30 janvier 2013
Le nom générique des AcM à usage thérapeutique
Nom Type Ex. d’anticorps
xxmOmab Mouse muromonab
(souris) britumomab
xxXImab Chimeric rituximab
(chimérique) cetuximab
XXZUmab Humanized trastuzumab
(humanisé) alemtuzumab
XxmUmab Fully Human panitumumab
(humain) adalimumab

AAEIP, AUF, Université Paris-Sud
30 janvier 2013
Modes d’action des AcM à usage thérapeutique en
oncologie : du ciblage des cellules tumorales …

AAEIP, AUF, Université Paris-Sud
30 janvier 2013
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
1
/
23
100%