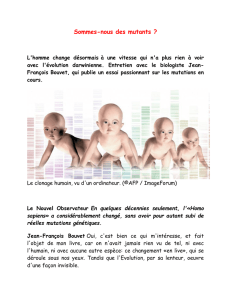
Le syndrome métabolique

Le syndrome
métabolique et ses
altérations
épigénétiques liées à la
nutrition

Introduction
Le syndrome métabolique, également connu sous le
nom syndrome X, n’est pas une maladie spécifique,
mais désigne plutôt une série de problèmes liés à un
mauvais métabolisme corporel : hauts taux d’insuline
et de cholestérol, hypertension et excès de poids.
Il constitue un stade précoce de plusieurs maladies
graves, comme le diabète de type II, les troubles
cardiovasculaires et les accidents vasculaires
cérébraux (AVC).

Introduction
Deux causes :
_Un style de vie sédentaire et une mauvaise
alimentation, pour la majorité des cas.
_L’hérédité
Pourquoi l’étudier ?
_Surtout présent chez les adultes, et de plus en plus
présent chez les jeunes occidentaux, et même chez
les enfants.
_En Amérique, On estime qu’un adulte sur quatre en
est atteint, soit environ 47 millions de personnes.
_En Europe, il toucherait 15 % des adultes.

Plan
Introduction
I. Le syndrome métabolique et son lien
avec l’épigénétique
1) Troubles métaboliques dus au syndrome
métabolique
2) Le code épigénétique
3) Relation entre épigénétique et nutrition
II. Les gènes soumis à empreinte
parentale
1) Définition
2) Implications dans le développement foeto-placentaire
3) Implication dans le développement post-natal
Conclusion

I. Le syndrome
métabolique et
son lien avec
l’épigénétique
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
1
/
25
100%