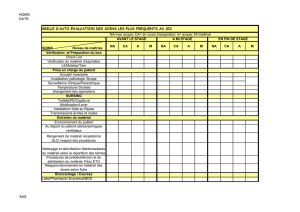
MATERIEL BIOLOGIQUE et APPROCHES

MATERIEL BIOLOGIQUE et APPROCHES EXPERIMENTALES
méthodes analytiques - spectrophotométriques
SPECTROPHOTOMETRIE D’ABSORPTION MOLECULAIRE
Principe
Utilise la capacité d’absorption de lumière d’une longueur d’onde fine et définie des
substances dissoutes dans l’eau.
Loi de Beer-Lambert (en expression logarithmique):
Log I0 /I = e . C .L = densité optique ou DO (directement proportionnelle à C)
I = énergie lumière transmise
I0 = énergie lumière incidente
C = concentration substance en mole/l dans le solvant
L = longueur du trajet optique (largeur de la cuve)
e = coefficient caractéristique de la longueur d’onde (coef. d’absorption moléculaire)
Si I=I0 -> le milieu est transparent, la transmission est de 100% et la DO = 0
Si I tend vers 0 , milieu opaque, la DO tend vers l’infini
Spectre d’absorption lumineuse :
représentation graphique des variations de densité optique de la lumière transmise
lors de modification de la longueur d’onde de la lumière incidente.
Spectres des substances : ultraviolet et visible.
Conditions définies : solvant, pH, O sinon variation de l’emplacement des longueurs
d’onde et de coefficient d’absorption

MATERIEL BIOLOGIQUE et APPROCHES EXPERIMENTALES
méthodes analytiques - spectrophotométriques
SPECTROPHOTOMETRIE D’ABSORPTION MOLECULAIRE
Appareillage
Nature
spectrophotomètres : toutes les longueurs d’ondes sont disponibles
Photomètres : certaines longueurs d’ondes
Caractéristiques
Sources lumineuses
solides chauffés (tungstène , visible-infrarouge)
(halogène, visible-UV)
décharges des gaz raréfiés (hydrogène ou deutérium( UV, continu)
(vapeur de mercure (UV, discontinu)
Fente d’entrée forme rectangulaire
Mono chromateur filtres colorés (verre ou gélatine)
Filtres interférentiels (verre + métal)
Prismes (dispersion de la lumière)
Réseaux (idem)
Fentes de sortie

MATERIEL BIOLOGIQUE et APPROCHES EXPERIMENTALES
méthodes analytiques - spectrophotométriques
SPECTROPHOTOMETRIE D’ABSORPTION MOLECULAIRE
Appareillage
Caractéristiques
Cuves verre -> visible
Quartz -> U.V.
polystyrène
Précautions d’utilisation (bulles, rayures,nettoyage)
Cellules photoélectriques -> transformation énergie lumineuse en énergie électrique
Tubes photomultiplicateurs
Lentilles, miroirs, fibres optiques
Amplificateurs
Galvanomètres (mesure le courant fourni par l’amplificateur)
Enregistreur
Appareils
photomètres : à filtres, peu coûteux
spectrophotomètres : à réseaux ou à prismes (intéressants pour les spectres)

MATERIEL BIOLOGIQUE et APPROCHES EXPERIMENTALES
méthodes analytiques - spectrophotométriques
SPECTROPHOTOMETRIE D’ABSORPTION MOLECULAIRE
Applications
Détermination du spectre caractérisation substance
Mesure de concentration directe (Hb. Protéines)
Indirecte (urée diacetylmonoxime)
Réflectométrie
Mesure de l’absorption lumineuse au cours du passage d’une lumière
monochromatique à travers une phase solide sur support réfléchissant.
Applications Lecture de plaques de chromatographie, de
bandelettes réactives
Analyse automatique
Luminométrie
Mesure de la lumière émise par réaction chimique (Chimioluminescence)
Applications réactions impliquant la luciférase (ATP ou O2)

MATERIEL BIOLOGIQUE et APPROCHES EXPERIMENTALES
méthodes analytiques - spectrophotométriques
PHOTOMETRIE DES MILIEUX TROUBLES
Opacimétrie
mesure de la lumière émise dans le même sens que la lumière incidente
Néphélémétrie
mesure de la lumière à 90° par rapport à la direction de la lumière incidente
Turbidimétrie
concentration ou épaisseur d’un milieu troublant la visibilité nette d’un test optique placé
derrière ce milieu
FLUORIMETRIE
Principe : une molécule à l’état stable recevant une énergie sous forme de rayonnement
passe à l’état excité. Le retour à l’état fondamental se traduit par l’émission de lumière
mesurable.
CHEMILUMINESCENCE
Dans ce cas, l’énergie est d’origine chimique ou enzymatique
Spectres
d’émission comporte une longueur d’onde pour laquelle l’intensité est
maximum
d’excitation comporte une longueur d’onde pour laquelle l’intensité est
maximum
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
1
/
43
100%