Aucun titre de diapositive

La diffusion en RMN
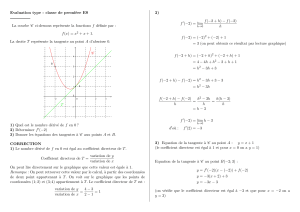
La mesure de la diffusion par RMN est rendue possible grâce à l’utilisation d’un
gradient de champ magnétique. Ce gradient de diffusion (Gd) superpose à B0un
champ magnétique de même direction, mais dont l’intensité dépend de la position r
dans l’espace : B=B0+Gdr.
Pour mesurer le coefficient de diffusion, Gdest appliqué sur une durée
.
Essentiellement, le système évolue ensuite pendant la durée , puis Gdest appliqué
une nouvelle fois pendant la durée
.
La distance moyenne parcourue pendant par un ensemble de molécules identiques
est liée au coefficient de diffusion Dde cette molécule par la relation (r-r0)(r-
r0)=6D.
L’effet du gradient de diffusion est de “déphaser ”le signal de chaque molécule,
selon la distance qu’elle parcourt pendant la durée de diffusion .L’ensemble des
ces déphasages individuels conduit statistiquement à une atténuation du signal qui
prend la forme :
où best égal à (γ
Gd)²(
-/3) et où S0est l’intensité du signal quand les gradients de
diffusion ne sont pas appliqués.
Une interpolation linéaire de ln(S/S0)en fonction de bpermet donc de déterminer le
coefficient de diffusion d’une molécule donnée. Si en fait, la molécule considérée est
répartie en plusieurs compartiments ayant chacun un coefficient de diffusion propre,
on peut quand même déterminer un coefficient apparent de diffusion (“apparent
diffusion coefficient”, ADC) qui traduira un comportement moyen.
bD
e
S
S
0
Mesure du coefficient de diffusion de métabolites
cérébraux par spectroscopie RMN
J.Valette1, L.Besret2, F.Boumezbeur1, P.Hantraye1,2, G.Bloch1, V.Lebon1
1CEA-SHFJ, Orsay, France, 2CNRS URA2210-SHFJ, Orsay, France
Introduction
Depuis plusieurs années l’Imagerie par Résonance Magnétique Nucléaire permet
d’obtenir des images du cerveau représentant le coefficient de diffusion de l’eau dans les
tissus cérébraux. Cette technique d’imagerie de diffusion a conduit, entre autres, au
développement du “fiber tracking ”(identification des faisceaux de fibres dans le
cerveau). Elle peut également être utilisée pour mesurer des variations du coefficient de
diffusion de l’eau au cours de processus neurodégénératifs.
Cependant, l’eau étant présente dans tous les compartiments du cerveau, la mesure de sa
diffusion apporte éventuellement une information structurelle, mais aucune information
sur le fonctionnement des neurones. La spectroscopie RMN permet, en revanche, de
détecter de nombreux métabolites cérébraux, et il est possible de mesurer leur coefficient
de diffusion en pondérant leur signal RMN en diffusion. Parmi les métabolites cérébraux,
le glutamate présente un intérêt majeur, puisqu’il est le principal neurotransmetteur
excitateur du cerveau.
Dans ce travail, le coefficient de diffusion du glutamate et d’autres métabolites a été
mesuré dans le cerveau de macaque sain sur un système corps entier à 3T (fig. 1a,
Bruker, Ettlingen, Allemagne), afin de valider nos choix méthodologiques et de disposer
de valeurs contrôles.
Matériels & méthodes
La séquence RMN utilisée a tout d’abord été optimisée in vivo afin d’obtenir le meilleur
signal possible pour le glutamate. Deux macaques ont été anesthésiés par une perfusion
intraveineuse de propofol. Chaque macaque a été étudié deux fois séparément. Un voxel
de 3.9 mL a été positionné au centre du cerveau, autour du striatum (fig. 1b).Les
expériences de diffusion (TR=2.5s, 360 répétitions, OVS de type BISTRO, suppression
de l’eau selon un schéma VAPOR) ont été acquises avec 6 différentes valeurs de b
(bmax~3000 s/mm²).
Les spectres obtenus ont été analysés par le logiciel LCModel [1], qui ajuste les spectres
expérimentaux par une combinaison linéaire de spectres de base (comprenant les
métabolites suivants : NAA, NAAG, glutamate, glutamine, lactate, myo-inositol,
creatine, aspartate, taurine, succinate, choline et glucose) et permet ainsi de mesurer leur
contribution respective, qui vont changer selon les valeurs de b.
Resultats & Discussion
La figure 2 montre un spectre acquis dans un cerveau de macaque,
ainsi que la contribution du glutamate au signal total, déterminée
par LCModel. L’ADC du glutamate, déterminé par régression
linéaire (fig. 3), est de 0.180.01µm²/s chez le premier macaque, et
0.160.01µm²/s chez le deuxième. Ces valeurs sont plus élevées
que celles déjà mesurées chez le rats (0.1120.002µm²/s, [2]). Cet
écart peut être le résultat de différences inter-espèce et/ou de
différences régionales de l’ADC (nos mesures chez le singe sont
sous-corticales). Le coefficient de diffusion de la créatine a été
évalué à 0.080.03µm²/s, celui du NAA à 0.140.04µm²/s. Là
aussi, les valeurs sont différentes de celles déterminées chez le rat
(0.1200.005µm²/s et 0.1070.003µm²/s respectivement).
Cette étude démontre la faisabilité de la mesure de l’ADC de
métabolites dans un voxel de 3.9mL dans le cerveau de singe sur
un aimant à corps entier. Les prochains développements incluent la
mesure de l’ADC dans différentes régions du cerveau
(corticales/sous-corticales). A plus long terme, ce travail devrait se
révéler utile à l’exploration de processus neurodégénératifs au
cours desquels des altérations du métabolisme ou de la
compartimentation de métabolites (en particulier du glutamate)
sont suspectées.
References
[1] Provencher, Magn Reson Med, 30, 672, 1993 [2] Pfeuffer et al., J. Cereb Blood Flow Metab, 20, 736, 2000
Principe de la résonance magnétique nucléaire
En présence d’un champ magnétique statique B0, certains noyaux atomiques vont
interagir avec B0(noyaux possédant un spin 0 comme l’hydrogène 1H). Ceci se
traduit par l’apparition de 2 niveaux d’énergie d’interaction (levée de
dégénérescence). Une description vectorielle du phénomène traduit l’orientation des
spins selon 2 directions : parallèle à B0(énergie d’interaction minimale) et
antiparallèle à B0(énergie d’interaction maximale). La distribution des spins selon
les 2 niveaux obéissant à une statistique de Boltzmann, une majorité des spins se
trouve dans la direction parallèle à B0,ce qui se traduit par l’apparition d’un moment
magnétique macroscopique Mparallèle à B0.
L’application d’un champ radiofréquence entraîne le basculement de Mdans le plan
perpendiculaire à B0.L’aimantation va ensuite précesser autour de B0tout en
regagnant son état d’équilibre.La fréquence de précession d’un spin, appelée
fréquence de résonance dépend avant tout du type de noyaux (1H, 13C, 15N, 17O…)et
du champ B0(relation de proportionnalité =γB0). Pour un type de noyau donné,
est légèrement modulée par la position du noyau dans la molécule. En effet, en
raison de l’écrantage de B0par le nuage électronique, tous les 1Hd’une même
molécule ne «voient» pas strictement le même B0. Chaque molécule a ainsi une
signature fréquentielle qui lui est propre. Un spectre RMN représente la
superposition de toutes ces contributions fréquentielles.
3.0 2.0 1.0
Fig 2. Spectre RMN acquis pour b=1123 s/mm².
La contribution au spectre du glutamate
déterminée par LCModel est indiquée en rouge
Fig 3. Décroissance du signal du glutamate en
fonction de la pondération en diffusion mesurée
dans un cerveau de singe
r2 = 0.9408
-0,6
-0,5
-0,4
-0,3
-0,2
-0,1
001000 2000 3000
b (s/mm²)
ln(S/S0)
1 cm
Fig 1. a: Système RMN corps-entier à 3 Tesla du CEA. b: Image RMN du cerveau
de singe. La région où est effectuée la mesure de diffusion (voxel
spectroscopique) est indiquée en bleu
a b
1
/
1
100%