Chapitre 1 Généralités sur la thermodynamique

Thermodynamique Chapitre 1
Généralités sur la thermodynamique
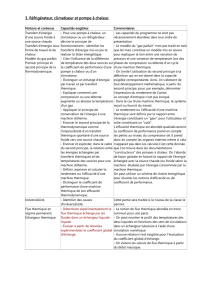
Définitions
Système isolé : aucun échange via les frontières
Système fermé : aucun échange de matière avec l’extérieur
Système isolé thermiquement : parois adiabatiques
Réversibilité : transformation pouvant être suivie en passant par le même chemin à part de
n’importe quel point d’équilibre
Température : mesure de l’énergie cinétique moyenne de translation des molécules
Principe zéro : si deux systèmes sont en équilibre thermique, alors ils sont eux-mêmes en équilibre
thermique
Equations d’état usuelles
Gaz parfait : =
Van der Waals (gaz + liquide) : +
2 = 0
avec b le covolume occupé par les autres molécules
Fonctions d’état
On appelle fonction d’état toute fonction à plusieurs variables de l’espace des variables d’état :
(,) par exemple.
Posons =,, on appelle « différentielle » de w la grandeur dw définie par :
=+,++(,)
En posant = et =, on a :
=
+
Relation entre les dérivées partielles
Soit ,,,,(,) :
= 1
=1
Coefficients thermoélastiques
=1
: coefficient de dilatation isobare
=1
: coefficient de variation de pression à volume constant
=1
: coefficient de compressibilité isotherme
1
/
1
100%