Lésions histologiques du SDRA

Lésions histologiques du
SDRA
THOMAS Sébastien (Grenoble)
Interne d’anesthésie réanimation
PAR, CHU Grenoble

Introduction I
•SDRA caractérisé par :
– Œdème pulmonaire aigu
–En rapport avec une augmentation de la perméabilité de
la membrane alvéolo-capillaire
• SDRA = expression d’un processus inflammatoire
complexe d’origine
–Pulmonaire
–Extra-pulmonaire : afflux de médiateurs de l’inflammation

Introduction II
•3 phases :
–Exsudative ou inflammatoire : J1 à J7
–Proliférative : à partir de J5
–Fibrotique finale :
•Considérée à partir de J10
•En fait phénomène plus précoce
•Conditionne le pronostic fonctionnel
–Phases se superposent mais régulées séparément
•Agression pulmonaire directe / indirecte
–Si agression pulmonaire directe :
• Plus d’œdème
•Plus de collapsus alvéolaire

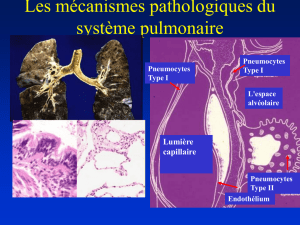
Alvéole normale
Barrière air/sang composé de :
–Épithélium alvéolaire
•Pneumocytes I
•Pneumocytes II
–Surfactant
–Réaction inflammatoire et immunitaire
– Réparation après lésion…
–Endothélium vasculaire
–Tissu conjonctif interstitiel entre les deux

Ware-NEJM-2000
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
1
/
19
100%