CHM 1978 cours 10

CHM 1978 –Chimie Analytique
Automne 2001
Cours 10 –Spectrophotométrie
Par: Sébastien Sauvé, Dominic Rochefort et
Thomas Ellis

Spectrophotométrie
La spectrophotométrie est l’utilisation de la lumière
pour mesurer la concentration d’une espèce
chimique.
•La lumière peu se comporter soit comme une onde ou comme une
particule. On parlera ainsi d’un photon d’une certaine longueur d’onde.
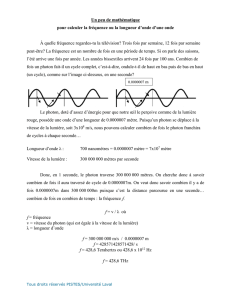
Longueur d’onde (): La distance du sommet d’une
oscillation au suivant. Habituellement en nm (10-9 m).
Fréquence (): c’est le nombre d’ondes complètes qui
passent à chaque seconde (les unités sont l’inverse de
secondes, s-1). Une oscillation par seconde est aussi
appelé un hertz (Hz), i.e., 106s-1 égale 106Hz ou 1 MHz.

Lumière
Un photon est une particule de lumière qui possède
une énergie.
Cette énergie dépend de sa longueur d’onde:
Ou de sa fréquence:
•E=Énergie du photon
•c=constante de Planck (6.62610-34 Js)
•c=vitesse de la lumière (2.99810-8 m/s) dans le vide
Selon son énergie, le photon peu interagir avec la
matière et provoquer différents types d’excitation
λ
hc
E
hνE

Spectre électromagnétique
Le spectre électromagnétique donne les différentes régions et interactions en
fonction de l’énergie et de la longueur d’onde des photons.
Spectre (Harris 1999, page 513)

Interaction lumière-matière
Quelque soit l’interaction mise en jeu, lorsqu’une
espèce absorbe la lumière (un photon) elle passe
dans un état excité.
Dans la spectrophotométrie ultraviolet visible, les
interactions lumière-matière impliquent des
excitations électroniques
Voir Figure 19-14 dans Harris 1999 page 528.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
1
/
12
100%