Devoir Surveillé Epreuve de CHIMIE - SVT104

SVE104 – DS du 14 Novembre 2009 1/3
Devoir Surveillé
Epreuve de CHIMIE - SVT104
Séries 1A, 1B & 1C
Samedi 14 Novembre 2009 (8h30-10h)
Documents non autorisés
Les différents exercices sont indépendants
Lire attentivement l’intégralité du sujet avant de commencer à répondre
La page n°3 est à remettre avec votre copie
Exercice 1
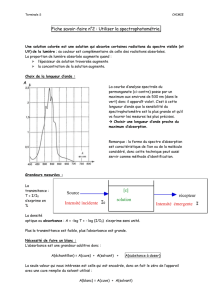
Une solution d’un composé A de concentration 2,34.10-4 mol.L-1 a une absorbance de 1,123 à
une longueur d’onde de 255 nm et une absorbance de 0,820 à 415 nm.
Une solution d’un composé B de concentration 4,6.10-5 mol.L-1 a une absorbance de 0,700 à
255 nm. Toutes les mesures ont été effectuées dans des cuves de 10 mm d’épaisseur.
1) Calculer les transmittances de chacune des solutions aux deux longueurs d’onde.
Un mélange des deux composés présente une absorbance de 0,772 à 255 nm et de 0,252 à 415
nm.
2) Quelles sont les concentrations de A et B dans le mélange ?
3) A l’état pur A et B sont solides. Quelle est leur couleur respective ?
N.B. : Le composé B n’absorbe pas à 415 nm.
Exercice 2
Le spectre de l’atome d’hydrogène observé par Balmer correspond à un retour de l’électron
d’un état excité vers le niveau d’énergie n = 2.
1) Comment est dissipé l’excès d’énergie ?
2) Rappeler la valeur de l’énergie d’un niveau n de l’atome d’hydrogène en eV.
3) Représenter graphiquement les trois transitions les plus faibles en énergie de la série de
Balmer.
4) Calculer la longueur d’onde des rayonnements associés à ces trois transitions.
Données :
h = 6,6261.10-34 J.s ; c = 2,9979.108 m.s-1 ; RH = 1,0974.107 m-1

SVE104 – DS du 14 Novembre 2009 2/3
Exercice 3
On considère les molécules PCl3 et AlCl3, l’atome central étant souligné.
1) Pour chacune des molécules établir la structure de Lewis. Préciser le schéma géométrique
de répulsion électronique, le formalisme de Gillespie, la forme de la molécule, les angles
de valence ainsi que l’état d’hybridation.
2) Rappeler la définition de l’électronégativité.
3) Pour chaque molécule, les liaisons sont polarisées. Justifier brièvement.
4) Pour PCl3, le moment dipolaire mesuré pour la liaison P-Cl vaut 0,56 D. En déduire la
valeur de la charge partielle δ.
5) Dans chaque cas préciser si la molécule, considérée dans son ensemble, présente un
moment dipolaire. Justifier graphiquement.
Données :
13Al χ=1,6 ; 15P χ=2,2 ; 17Cl χ=3,2
distance Al-Cl = 0,228 nm ; distance P-Cl = 0,204 nm

SVE104 – DS du 14 Novembre 2009 3/3
NOM / Prénom :_________________________________ Groupe :_______________
Exercice 4
Pour chaque élément compléter le tableau ci-dessous :
Nombre de protons 11 17 24
Nombre de neutrons 12 18
Nombre d’électrons 10 18 22
Numéro atomique
Nombre de masse 52
Element
Symbole
Famille
Degré d’oxydation
Exercice 5
Compléter le tableau suivant :
Atome Symbole Z Ligne Colonne
Configuration électronique de la
couche de valence
Hydrogène
Ne
9
2 2
3 8 électrons
K
Phosphore
3d1 4s2
1
/
3
100%