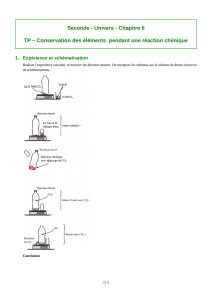
O 2

On évalue la quantité de fer détruite
annuellement par corrosion à
1/4 de la production annuelle de fer !

La corrosion désigne le phénomène par lequel, les
métaux tendent à revenir à l’état sous lequel ils se
trouvent dans la nature :
oxydes, sulfates, carbonates, …
Les métaux qui, comme l’or se trouvent dans le sol
àl’état natif résistent très bien à la corrosion .
Le fer est présent, à l’état naturel, sous forme
d’oxydes.
Il doit être réduit dans des hauts-fourneaux .

Ferrihydrite (Islande)
5FeOOH.2H2O
Goethite (France)
-FeOOH
R.M .Cornnel et U. Schwertmann, Iron Oxides (VCH ed. 1996)

Hématite (Brésil)
Fe2O3
Lépidocrocite (Brésil)
-FeOOH
R.M .Cornnel et U. Schwertmann, Iron Oxides (VCH ed. 1996)

Fe2+ et oxyde ferrique
Comment expliquez vous la
présence de Fe2+?
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
1
/
29
100%