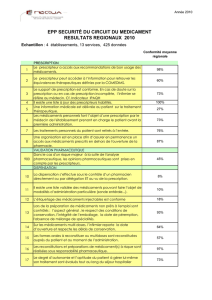
la prescription medicale. la prescription medicale.

La prescription La prescription
La prescription La prescription
médicalemédicale
médicalemédicale
La pharmacovigilanceLa pharmacovigilance
Elisabeth Eccher Elisabeth Eccher
DU 2011DU 2011

PLANPLAN
••
La prescription médicaleLa prescription médicale
••
La prescription médicaleLa prescription médicale
•• Réglementation de la prescription médicaleRéglementation de la prescription médicale
•• Réglementation infirmière vis à vis de la Réglementation infirmière vis à vis de la
itiiti
prescr
i
p
ti
onprescr
i
p
ti
on
•• L’infirmier et le protocole d’urgenceL’infirmier et le protocole d’urgence
•• La
p
rescri
p
tion
p
ar télé
p
honeLa
p
rescri
p
tion
p
ar télé
p
hone
ppp pppp p
•• Classification des médicamentsClassification des médicaments
•• Délivrance des ordonnancesDélivrance des ordonnances
••
AMMAMM
••
AMMAMM
••ATUATU
•• PharmacovigilancePharmacovigilance
•• Objectifs de la pharmacovigilanceObjectifs de la pharmacovigilance
•• Les obligations de signalementLes obligations de signalement
••
Rôle des professionnels de santéRôle des professionnels de santé
••
Rôle des professionnels de santéRôle des professionnels de santé
•• Organisation de la pharmacovigilanceOrganisation de la pharmacovigilance

La prescription médicaleLa prescription médicale
•• Répond à des règles strictes définies par le code de Répond à des règles strictes définies par le code de
l
a
sa
n
té
pub
li
que
.l
a
sa
n
té
pub
li
que
.
a sa té pub quea sa té pub que
•• L’article R.4311L’article R.4311--7 précise:<< l’infirmière est 7 précise:<< l’infirmière est
habilitée à pratiquer les actes suivants….soit en habilitée à pratiquer les actes suivants….soit en
application d’une prescription médicale qui sauf application d’une prescription médicale qui sauf
application d’une prescription médicale qui sauf application d’une prescription médicale qui sauf
urgence, est écrite, qualitative et quantitatif, datée urgence, est écrite, qualitative et quantitatif, datée
et signée, soit en application d’un protocole écrit , et signée, soit en application d’un protocole écrit ,
é l bl t ét bli d té t i é éd ié l bl t ét bli d té t i é éd i
pr
é
a
l
a
bl
emen
t ét
a
bli
,
d
a
té
e
t
s
i
gn
é
par
un
m
éd
ec
i
n.pr
é
a
l
a
bl
emen
t ét
a
bli
,
d
a
té
e
t
s
i
gn
é
par
un
m
éd
ec
i
n.
••
IL EXISTE DEUX TYPES DE SUPPORTSIL EXISTE DEUX TYPES DE SUPPORTS
IL EXISTE DEUX TYPES DE SUPPORTSIL EXISTE DEUX TYPES DE SUPPORTS
–– La prescription manuscriteLa prescription manuscrite
–– La prescription informatiqueLa prescription informatique

La prescription médicaleLa prescription médicale
• Les personnes habilitées à prescrire :
–
Les médecins
–
Les médecins
– Les directeurs de laboratoires d’analyses de
biologie médicale (dans les limites prévues à
l’ ti l L761)
l’
ar
ti
c
l
e
L761)
– Les chirurgiens dentistes pour l’usage de l’art
dentaire
,
,
– Les docteurs vétérinaires pour la médecine
vétérinaire,
L f (d l li it d l li t
–
L
es
sages
f
emmes
(d
ans
l
es
li
m
it
es
d
e
l
a
li
s
t
e
mentionnée à l’article L 370)

EXISTEEXISTE
--
TT
--
IL UNE PRESCRIPTION IL UNE PRESCRIPTION
EXISTEEXISTE
--
TT
--
IL UNE PRESCRIPTION IL UNE PRESCRIPTION
INFIRMIEREINFIRMIERE
Les infirmiers depuis le 15 avril 2007 sont autorisés à prescrire
certains dispositifs médicaux dont la liste est fixée (arrêté du13/4/07)
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
1
/
46
100%