notice - Pharmacie du Lac

NOTICE
ANSM - Mis à jour le : 02/03/2016
Dénomination du médicament
DECAN, solution à diluer pour perfusion
Encadré
Veuillez lire attentivement l'intégralité de cette notice avant d'utiliser ce médicament car elle contient des
informations importantes pour vous.
·Gardez cette notice, vous pourriez avoir besoin de la relire.
·Si vous avez d’autres questions, interrogez votre médecin, votre pharmacien ou votre infirmier/ère.
·Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d'autres personnes. Il pourrait lui
être nocif, même si les signes de leur maladie sont identiques aux vôtres.
·Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou à votre pharmacien. Ceci
s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
Sommaire notice
Que contient cette notice :
1. qu'est-ce que DECAN, solution à diluer pour perfusion et dans quels cas est-il utilise ?
2. quelles sont les informations à connaitre avant d'utiliser DECAN, solution à diluer pour perfusion ?
3. comment prendre DECAN, solution à diluer pour perfusion ?
4. quels sont les effets indésirables éventuels ?
5. comment conserver DECAN, solution à diluer pour perfusion ?
6. informations supplémentaires
1. QU'EST-CE QUE DECAN, solution à diluer pour perfusion ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique
Classe pharmacothérapeutique : Solution d'oligo-éléments pour perfusion.
Code ATC : B05XA31
Indications thérapeutiques
Elle contient 10 oligo-éléments essentiels (fer, cuivre, manganèse, zinc, fluor, cobalt, iode, sélénium, chrome,
molybdène).
Ces oligo-éléments sont considérés comme essentiels car l'organisme ne peut les synthétiser bien qu'il en ait
besoin en très petites quantités pour pouvoir fonctionner correctement.
DECAN est utilisé comme source d'oligo-éléments chez les adultes nécessitant une nutrition par voie
intraveineuse.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D'UTILISER DECAN, solution à diluer pour
perfusion ?
Liste des informations nécessaires avant la prise du médicament
Sans objet.
Contre-indications
Notice patient
http://agence-prd.ansm.sante.fr/php/ecodex/notice/N0276486.htm
1 sur 6 22/04/2016 09:57

N'utilisez jamais DECAN, solution à diluer pour perfusion :
·si vous êtes allergique (hypersensible) aux substances actives ou à l'un des autres composants contenus
dans ce médicament, mentionnés dans la rubrique 6,
·si votre poids est inférieur à 40 kg,
·si votre sang contient un taux anormalement élevé de l'un des composants du produit. (Si vous avez un
doute, parlez-en à votre médecin),
·si vous souffrez d'une cholestase prononcée (jaunissement de la peau ou du blanc des yeux causé par un
problème sanguin ou hépatique),
·si votre organisme présente un excès de cuivre (maladie de Wilson) ou de fer (hémochromatose).
DECAN ne doit pas être utilisé chez l'enfant.
Précautions d'emploi ; mises en garde spéciales
Mises en garde et précautions d’emploi
Adressez-vous à votre médecin avant d’utiliser DECAN, solution pour perfusion.
·Si vous avez des problèmes rénaux,
·Si vous souffrez de problèmes hépatiques tels qu'une cholestase modérée (insuffisance hépatique avec
jaunissement de la peau ou du blanc des yeux),
·Si vous recevez des transfusions sanguines répétées.
Les taux sanguins d'oligo-éléments doivent être régulièrement contrôlés pendant le traitement.
Votre médecin adaptera le dosage de DECAN.
Interactions avec d'autres médicaments
Autres médicaments et DECAN, solution pour perfusion
Informez votre médecin si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament.
Interactions avec les aliments et les boissons
Sans objet.
Interactions avec les produits de phytothérapie ou thérapies alternatives
Sans objet.
Utilisation pendant la grossesse et l'allaitement
Grossesse et allaitement
Comme pour tout médicament, vous devez informer votre médecin ou le personnel infirmier :
·Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse,
demandez conseil à votre médecin avant de prendre ce médicament.
DECAN ne doit pas être utilisé pendant la grossesse ou l'allaitement, à moins que le médecin l'estime
absolument nécessaire.
Sportifs
Sans objet.
Effets sur l'aptitude à conduire des véhicules ou à utiliser des machines
Sans objet.
Notice patient
http://agence-prd.ansm.sante.fr/php/ecodex/notice/N0276486.htm
2 sur 6 22/04/2016 09:57

Liste des excipients à effet notoire
DECAN, solution pour perfusion, contient du sodium. Le taux de sodium (0.078 mmol soit 1.796 mg) est
inférieur à 1 mmol par dose, c'est à dire « sans sodium ».
3. COMMENT PRENDRE DECAN, solution à diluer pour perfusion ?
Instructions pour un bon usage
Sans objet.
Posologie, Mode et/ou voie(s) d'administration, Fréquence d'administration et Durée du traitement
DECAN est réservé aux patients adultes seulement.
DECAN sera administré par voie intraveineuse (dans une veine).
Pour plus d'informations sur l'utilisation de ce produit, consultez votre médecin.
Posologie
DECAN n'est pas destiné à être administré tel quel. Il doit être dilué en tenant compte de l'osmolarité finale
désirée.
Par exemple, 40 ml de DECAN peuvent être dilués dans :
·au moins 250 ml de solution pour perfusion de chlorure de sodium à 0.9%,
·ou au moins 500 ml de solutions pour perfusion de glucose à une concentration allant de 5 à 70 %.
En cas de dilution dans des solutions de glucose à une concentration supérieure à 20%, la dilution ne doit pas
être administrée seule compte tenu de l'osmolarité finale.
DECAN peut aussi être ajouté tel quel dans des mélanges de nutrition parentérale. Dans ce cas, vérifier
soigneusement la compatibilité.
Ne pas conserver des flacons entamés et jeter tout le matériel après utilisation.
Symptômes et instructions en cas de surdosage
Si vous avez utilisé plus de DECAN, solution à diluer pour perfusion que vous n'auriez dû :
La quantité d'oligo-éléments contenue dans DECAN, est nettement inférieure aux niveaux toxiques connus. Par
conséquent, un surdosage est hautement improbable.
Si votre médecin soupçonne un surdosage, il interrompra le traitement par DECAN et effectuera les analyses
nécessaires.
Instructions en cas d'omission d'une ou de plusieurs doses
Sans objet.
Risque de syndrome de sevrage
Sans objet.
Si vous avez d'autres questions sur l'utilisation de ce médicament, demandez plus d'informations à votre
médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Description des effets indésirables
Comme tous les médicaments, ce médicament peut provoquer des effets indésirables, mais ils ne surviennent
pas systématiquement chez tout le monde.
Consultez votre médecin si vous remarquez l'effet indésirable suivant :
Fréquence indéterminée (ne peut être estimée sur la base des données disponibles) : douleur au site
d'administration.
Déclaration des effets secondaires
Notice patient
http://agence-prd.ansm.sante.fr/php/ecodex/notice/N0276486.htm
3 sur 6 22/04/2016 09:57

Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, à votre pharmacien ou à votre
infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous
pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence
nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de
Pharmacovigilance - Site internet: www.ansm.sante.fr
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du
médicament.
5. COMMENT CONSERVER DECAN, solution à diluer pour perfusion ?
Tenir ce médicament hors de la vue et de la portée des enfants.
Date de péremption
N’utilisez pas ce médicament après la date de péremption mentionnée sur la boîte après EXP. La date
d'expiration fait référence au dernier jour de ce mois.
Avant utilisation, vérifiez que la solution est homogène et que le flacon est indemne ou exempt de fêlures ou
d'éclats.
Après utilisation, la solution restante doit être jetée.
Vérifier la compatibilité avec les solutions administrées simultanément avec un même cathéter.
Conditions de conservation
A conserver à une température ne dépassant pas 25°C.
Conserver le conditionnement primaire dans l'emballage extérieur, à l'abri de la lumière.
Ne pas congeler.
Après dilution, la stabilité chimique et physique a été démontrée durant 24 h à 25°C. D'un point de vue
microbiologique, le produit doit être utilisé immédiatement après dilution ou addition. S'il n'est pas utilisé
immédiatement, le temps et les conditions de conservation avant usage sont de la responsabilité de l'utilisateur
et ne devraient normalement pas dépasser 24 h à 5°C à moins que la dilution ou l'addition se soit déroulée dans
des conditions d'asepsie validées et contrôlées.
Si nécessaire, mises en garde contre certains signes visibles de détérioration
Ne jetez aucun médicament au tout à l'égout ni avec les ordures ménagères. Demandez à votre pharmacien
d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l'environnement.
6. INFORMATIONS SUPPLEMENTAIRES
Liste complète des substances actives et des excipients
Ce que contient DECAN, solution à diluer pour perfusion
Les substances actives sont :
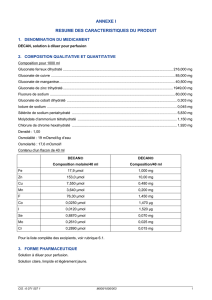
Gluconate ferreux ....................................................................................................................... 199,900 mg
Gluconate de cuivre ..................................................................................................................... 85,000 mg
Gluconate de manganèse ............................................................................................................. 40,500 mg
Gluconate de zinc ...................................................................................................................... 1742,00 mg
Fluorure de sodium ...................................................................................................................... 80,000 mg
Gluconate de cobalt ....................................................................................................................... 0,280 mg
Iodure de sodium ........................................................................................................................... 0,045 mg
Sélénite de sodium ........................................................................................................................ 3,830 mg
Molybdate d'ammonium ................................................................................................................. 1,080 mg
Chlorure de chrome ....................................................................................................................... 1,140 mg
Pour 1000 ml de solution pour perfusion.
Contenu d'un flacon de 40 ml
DECAN
Composition molaire/40 ml
DECAN
Composition/40 ml
Fe 17,9 µmol 1,000 mg
Notice patient
http://agence-prd.ansm.sante.fr/php/ecodex/notice/N0276486.htm
4 sur 6 22/04/2016 09:57

Zn 153,0 µmol 10,00 mg
Cu 7,550 µmol 0,480 mg
Mn 3,640 µmol 0,200 mg
F 76,30 µmol 1,450 mg
Co 0,0250 µmol 1,470 µg
I 0,0120 µmol 1,520 µg
Se 0,8870 µmol 0,070 mg
Mo 0,2610 µmol 0,025 mg
Cr 0,2890 µmol 0,015 mg
Osmolalité : 19 mOsmol/kg d'eau
Osmolarité : 17,6 mOsmol/l
Densité : 1,00
Les autres composants sont :
Glucono delta-lactone, eau pour préparations injectables.
Forme pharmaceutique et contenu
Aspect de DECAN, solution à diluer pour perfusion et contenu de l'emballage extérieur
C'est une solution claire limpide et légèrement jaune en flacon de 50 ml (verre incolore de type II) rempli à 40 ml;
Boîte de 1 ou de 25.
Ne pas utiliser le produit, si l'intégrité du flacon est endommagée, ou si la solution n'est pas claire, limpide, et
légèrement jaune claire.
Toutes les présentations peuvent ne pas être commercialisées.
Nom et adresse du titulaire de l'autorisation de mise sur le marché et du titulaire de l'autorisation de
fabrication responsable de la libération des lots, si différent
Titulaire
LABORATOIRE AGUETTANT
1 RUE ALEXANDER FLEMING
69007 LYON
Exploitant
LABORATOIRE AGUETTANT
1 RUE ALEXANDER FLEMING
69007 LYON
Fabricant
LABORATOIRE AGUETTANT
1 RUE ALEXANDER FLEMING
69007 LYON
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms
suivants :
Conformément à la réglementation en vigueur.
Date d’approbation de la notice
La dernière date à laquelle cette notice a été révisée est < {MM/AAAA}>< {mois AAAA}.>
AMM sous circonstances exceptionnelles
Sans objet.
Notice patient
http://agence-prd.ansm.sante.fr/php/ecodex/notice/N0276486.htm
5 sur 6 22/04/2016 09:57
 6
6
1
/
6
100%