C4 les esters - Physique

PARTIE 1 : DES MOLECULES DE LA SANTE CHIMIE
1 / 4
Les esters
Les esters sont des molécules organiques naturelles à l’origine de l’odeur caractéristique de certains fruits ou de
certaines fleurs. Plusieurs esters peuvent se lier entre eux pour former des polyesters très utilisés en médecine ou
dans le domaine des textiles.
I. Groupe caractéristique des esters
1) Formule générale
Les esters sont des composés chimiques qui dérivent des acides carboxyliques et des alcools.
Leur groupe caractéristique est :
Formule développée :
Formule semi-développée :
La formule brute des esters est identique à celle des acides carboxyliques : CnH2nO2
2) Nomenclature
Le nom d'un ester comporte deux termes :
- Le premier, qui se termine en - oate, désigne la chaîne dite principale provenant de l'acide carboxylique.
Cette chaîne est, si nécessaire, numérotée à partir de l'atome de carbone fonctionnel.
- Le second, qui se termine en -yle, est le nom du groupe alkyle provenant de l'alcool. Cette chaîne est, si
nécessaire, numérotée à partir de l'atome de carbone lié à l'atome d'oxygène.
Les deux parties sont nommées selon la nomenclature systématique :
Nombre de carbone
1
2
3
4
Nom de l’alcane
Méthane
Ethane
Propane
Butane
Nom de la 1ère partie de l’ester
Méthanoate
Ethanoate
Propanoate
Butanoate
Nom de la 2ème partie de l’ester
Méthyle
Ethyle
Propyle
Butyle
Exemples :
Certains esters ont conservé leur nom trivial qui indique généralement leur origine naturelle comme l’acétate
d’amyle au parfum de poire de formule chimique : (son nom systématique est l’éthanoate de pentyle)
II. Synthèse et hydrolyse d’un ester
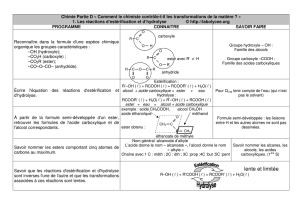
1) Réaction d’estérification
La réaction chimique ayant lieu entre un acide carboxylique et un alcool conduit à la synthèse d’un ester.
On appelle donc cette réaction : l’estérification :
........................................ + ........................................ = ........................................................ + H2O
L’estérification est une réaction très lente. Deux facteurs permettent de l’accélérer :
- Le chauffage du milieu réactionnel grâce à un montage à reflux.
- L’addition d’un catalyseur chimique : quelques gouttes d’acide sulfurique par exemple.
Chapitre n°4

PARTIE 1 : DES MOLECULES DE LA SANTE CHIMIE
2 / 4
Evolution au cours du temps de la quantité de matière d’ester formé lors de l’estérification d’un mélange
équimolaire d’acide (nacide = 1 mol) et d’alcool (nalcool = 1 mol) :
Observation :
D’après la courbe, on s’aperçoit que la quantité de matière d’ester formé
au maximum est nester = 0,67 mol.
Il reste donc nacide = 1 – 0,67 = 0,33 mol qui n’a pas réagi.
Conclusion :
La réaction d’estérification est donc limitée. Elle n’est pas totale.
Calcul du rendement de la réaction :
On définit le rendement d’une réaction par la formule : η =
(produit)n (produit)n
max
f
Le rendement η (éta) est sans unité. Si η < 1 la réaction est limitée.
Dans le cas ci-dessus, la quantité de matière d’ester à l’état final vaut : nf(ester) = 0,67 mol et la quantité
maximale, que l’on aurait dû obtenir si la réaction était totale, est nmax(ester) = 1 mol. On a donc le
rendement suivant :
η =
67,0
1
67,0
(ester)n (ester)n
max
f
. Le rendement de la réaction d’estérification est donc de 67 %.
2) Hydrolyse d’un ester
La réaction chimique permettant la destruction d’un ester par l’eau est appelée : hydrolyse. C’est la
réaction inverse de l’estérification :
........................................................ + H2O = ........................................ + ........................................
L’hydrolyse est une réaction très lente. Deux facteurs permettent de l’accélérer :
- Le chauffage du milieu réactionnel grâce à un montage à reflux.
- L’addition d’un catalyseur chimique : quelques gouttes d’acide sulfurique par exemple.
Evolution au cours du temps de la quantité de matière d’ester consommé lors de l’hydrolyse de
nester = 1 mol :
Observation :
D’après la courbe, on s’aperçoit que la quantité de matière d’ester
consommé au maximum est nester = 0,67 mol.
Il s’est donc formé nacide = nalcool = 1 – 0,67 = 0,33 mol.
Conclusion :
La réaction d’hydrolyse est donc limitée. Elle n’est pas totale.
Calcul du rendement de la réaction :
Dans le cas ci-dessus, la quantité de matière d’acide à l’état final vaut : nf(acide) = 0,33 mol et la quantité
maximale, que l’on aurait dû obtenir si la réaction était totale, est nmax(acide) = 1 mol. On a donc le
rendement suivant :
η =
33,0
1
33,0
(acide)n (acide)n
max
f
. Le rendement de la réaction d’hydrolyse est donc de 33 %.

PARTIE 1 : DES MOLECULES DE LA SANTE CHIMIE
3 / 4
3) L’équilibre estérification-hydrolyse
Rappel : les réactions d’estérification et d’hydrolyse sont lentes et limitées.
Lorsque se déroule la réaction d'estérification, des molécules d'acide et des
molécules d'alcool, réagissent, en présence d'ions H+(catalyseur), pour donner
des molécules d'ester et d'eau selon l'équation :
acide + alcool = ester + eau
Inversement, un mélange initialement constitué de molécules d'eau et de
molécules d'ester évolue, en présence d'ions H+(catalyseur), pour donner des
molécules d'acide et d'alcool selon l'équation :
ester + eau = acide + alcool
Les réactions d'estérification et d'hydrolyse se produisent simultanément
et se limitent l'une l'autre, conduisant à un état d'équilibre dynamique.
L’estérification et l’hydrolyse d’un ester sont des réactions inverses et en équilibre chimique.
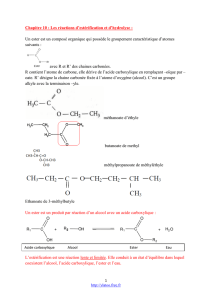
III. Les triglycérides
1) Le glycérol et les acides gras
Le glycérol (ou glycérine) est un trialcool. Son nom en nomenclature systématique est le propan-1,2,3-triol
de formule semi-développée : et de formule brute : C3H8O3.
Le glycérol possède donc trois groupes hydroxyles –OH. C’est l’un des réactifs permettant la synthèse de
triglycérides.
Les acides gras sont des acides carboxyliques comportant une très longue chaîne carbonée de formule
générale : R–COOH (avec R : ramification d’au moins 4 atomes de carbone).
Le glycérol s’associe donc à trois molécules d’acides gras pour former un triester appelé triglycéride.
Remarque : les triglycérides comme les acides gras font partie de la famille des lipides.
Les triglycérides dans le sang sont systématiquement recherchés lors d'un bilan lipidique au même titre que
le cholestérol.
2) Estérification du glycérol par des acides gras
Equation-bilan de la réaction de formation d’un triglycéride :
..........................................
.......................................... + + 3 H2O
..........................................
3 acides gras glycérol triglycéride eau
(trialcool) (triester)
Un triglycéride est un triester obtenu par condensation de glycérol et de trois molécules d’acides gras.
Un triglycéride comporte donc trois groupes ester.
CH2CH CH2
OH OH OH

PARTIE 1 : DES MOLECULES DE LA SANTE CHIMIE
4 / 4
3) Hydrolyse d’un triglycéride
Equation-bilan de la réaction d’hydrolyse d’un triglycéride :
..........................................
+ 3 H2O .......................................... +
..........................................
triglycéride eau 3 acides gras glycérol
(triester) (trialcool)
L’hydrolyse d’un triester est la réaction inverse de l’estérification. On assiste donc à un équilibre
estérification-hydrolyse.
4) Corps gras saturés et insaturés ; effet sur la santé
Les corps gras sont des lipides et désigne donc les acides gras et les triglycérides.
Corps gras
insaturé
saturé
Caractéristiques
Chaîne carbonée comportant une ou
plusieurs double(s) liaison(s) C=C
Chaîne carbonée ne comportant que des
liaisons simples C–C
Exemples
C18H34O2 : acide oléique
C18H36O2 : acide stéarique
Hydrogénation de
corps gras insaturés
C17H33–COO–CH222222222
|
C17H33–COO–CH2 + 3 H2
|
C17H33–COO–CH222222222
Oléine
C17H35–COO–CH222222222
|
C17H35–COO–CH2 + 3 H2
|
C17H35–COO–CH222222222
Stéarine
Les corps gras mono-insaturés et certains corps gras poly-insaturés sont bénéfiques pour l’appareil
cardiovasculaire. Les corps gras saturés sont déconseillés.
IV. Les polyesters
1) Synthèse de polyesters : la polycondensation
Les polyesters, comme les polyamides, sont des macromolécules formées à partir de petites molécules
(appelées monomères) liées entre elles par des fonctions ester. Les polyesters sont nombreux et variés. Parmi
les nombreuses applications des polyesters, on trouve les fibres textiles utilisées dans les vêtements, les
emballages…
Polycondensation de l’acide lactique :
...................................................... ................................................. + (n-1) H20
Ce polyester est intéressant en raison de sa dégradabilité et sa biocompatibilité. La dégradation de ce
polymère donne de l'acide lactique que l'organisme sait éliminer. C'est un biomatériau.
2) Les biomatériaux
Un biomatériau est un matériau non vivant utilisé et conçu pour interagir avec des systèmes biologiques. Ces
matériaux peuvent être divisés en deux groupes: les composés biostables (prothèses, organes artificiels) et les
composés biorésorbables. Ces derniers sont dégradés; c'est le cas des fils de sutures, des pièces
d'ostéosynthèse par exemple. Ces polymères biodégradables peuvent aussi avoir des applications dans le
cadre de l'environnement et du développement durable (agriculture, emballages).
1
/
4
100%