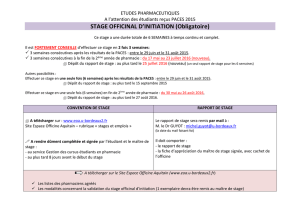
PACES 2013

UE1: Liaisons chimiques
PACES 2013 0
But du cours: connaître les différents types de liaisons et
comprendre la formation de liaisons covalentes entre les atomes
Intervenants: E. Baudrin
J-P. Becker, C. Cézard, P. Vanlemmens

Variation de l’électronégativité
PACES 2013 1

Les différents types de liaisons
Intramoléculaires chimiques
Liaison ionique typiquement 500-1000 kJ.mol-1
Liaison covalente 100-600 kJ.mol-1
Liaison métallique 100-800 kJ.mol-1
PACES 2013 2
Intermoléculaires physiques
Liaisons van der Waals 1-10 kJ.mol-1
Liaisons hydrogène 5-40 kJ.mol-1

Plan du cours
- Modèle de Lewis
- Liaison ionique
- Combinaison linéaire d’orbitales
atomiques
- Méthode de Gillespie
- Liaisons faibles: Van der Waals et
liaisons hydrogène
PACES 2013 3
- Modèle de Lewis
- Liaison ionique
- Combinaison linéaire d’orbitales
atomiques
- Méthode de Gillespie
- Liaisons faibles: Van der Waals et
liaisons hydrogène

Liaisons covalentes
Hypothèses de Lewis et Langmuir
« Dans une molécule comme H2ou CH4, l’établissement de la
liaison entre deux atomes est dû à la mise en commun d’un couple
d’électrons dont chaque protagoniste fournit la moitié »
PACES 2013 4
C Z=6 1s22s22p2
Représentation d’une molécule:
Ex: H Z=1 1s1
Cl Z=17 1s22s22p63s23p5
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
1
/
43
100%