Chimie Synthèse d`un arome de banane Chap.21

17/05/2014 C20_Synthese_arome_banane.doc 1/3
TS
Thème : Agir
TP n°28
Chimie
Synthèse d’un arome de banane
Chap.21
But du TP : Réaliser la synthèse d’une espèce organique en justifiant le choix des protocoles de synthèse, de séparation,
de purification et de caractérisation de l’espèce formée.
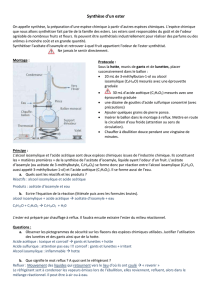
I. Principe
Les esters volatils sont souvent utilisés pour produire des arômes et des fragrances
synthétiques.
On désire préparer un ester dont la saveur et l’odeur sont ceux de la banane. Cet ester,
l’acétate d’isoamyle se présente sous la forme d’un liquide transparent incolore. On le
retrouve dans les pommes mûres et il est utilisé dans les peintures ou comme agent de saveur (bonbon
« arlequin »). C’est aussi la phéromone d’alarme de l’abeille.
L’équation de la réaction de la synthèse étudiée peut s’écrire :
Données :
Espèces chimiques
Propriétés physiques
Pictogrammes
Alcool
isoamylique
M = 88,1 g.mol-1 ; θéb = 128°C ; d = 0,81
Peu soluble dans l’eau et encore moins
soluble dans l’eau froide et salée.
Acide acétique
M = 60,1 g.mol-1 ; θéb = 118°C ; d = 1,05
Très soluble dans l’eau.
Acétate
d’isoamyle
M = 130,2 g.mol-1 ; θéb = 142°C ; d = 0,87
Très peu soluble dans l’eau et encore moins
soluble dans l’eau froide et salée.
Eau salée
densité d = 1,3
1) Avant toute manipulation, quelles sont les précautions à prendre concernant cette synthèse ?
II. Protocole expérimental
Synthèse
Dans un ballon, introduire un volume V1 = 10 mL d’alcool isoamylique, puis un volume V2 = 20 mL d’acide
acétique.
Ajouter une spatule d’acide paratoluènesulfonique (APTS) et une dizaine de grains de pierre ponce.
Préparer le montage à reflux et maintenir une ébullition douce pendant 20 min.
Arrêter le chauffage et laisser refroidir le ballon (tout en maintenant la circulation d’eau dans le réfrigérant).
Placer le ballon dans un bain d’eau froide.

17/05/2014 C20_Synthese_arome_banane.doc 2/3
Séparation
Verser le contenu du ballon dans une ampoule à décanter (sans la pierre ponce).
Y ajouter environ 50 mL d’eau salée (solution aqueuse saturée en chlorure de sodium) : 2 phases apparaissent.
Agiter, puis laisser décanter. Eliminer la phase aqueuse.
Laver la phase organique en versant 20 mL d’une solution saturée d’hydrogénocarbonate de sodium (Na+(aq) +
HCO3-(aq)).
Agiter tout en dégazant régulièrement, puis laisser décanter. Eliminer la phase aqueuse.
Récupérer la phase organique dans un erlenmeyer et mesurer la masse mexp de la phase organique et son volume
Vexp.
Purification
On pourrait distiller la phase organique et recueillir la fraction passant au-dessus de 135°C (voir montage de
distillation).
Caractérisation
Calculer la densité du produit synthétisé et utiliser son spectre IR pour identifier cette espèce.
III. Exploitation
1. Analyse de la synthèse
1.1. À quel type de réaction appartient cette réaction chimique ?
1.2. Identifier la fonction chimique des réactifs et du produit.
1.3. En déduire le nom de cette réaction.
1.4. Nommer les espèces présentes dans l’équation dans la nomenclature IUPAC (International Union of Pure and
Applied Chemistry).
1.5. Quel est le rôle de l’APTS ? De la pierre ponce ? Du chauffage ? Pourquoi refroidit-on le milieu
réactionnel ?
2. Analyse de la séparation
2.1. A la fin de la réaction, reste-t-il de l’acide acétique ou de l’alcool isoamylique dans le ballon ? Justifier par
un calcul.
2.2. Quel est le rôle de l’ampoule à décanter ? Justifier la position relative des deux phases.
2.3. Pourquoi garde-t-on la phase organique ?
2.4. Écrire l’équation lors du lavage, sachant que les couples acide/base sont (CO2,H2O / HCO3-) et (CH3CO2H /
CH3CO2-).
2.5. En déduire le rôle de ce lavage et la raison de la surpression observée.
3. Analyse de la purification
3.1. Légender le montage de distillation ci-contre.
3.2. Quel est le rôle de la distillation ?
3.3. Calculer le rendement η (en %) de la synthèse.
Conclure.
4. Analyse de la caractérisation
4.1. Utiliser les données pour vérifier que l’espèce
synthétisée est bien de l’acétate d’isoamyle.
4.2. Le spectre de RMN de l’ester obtenu présente les
signaux suivants (entre autres) :
un doublet correspondant à six protons ;
un singulet correspondant à trois protons ;
un triplet correspondant à deux protons.
Attribuer ces signaux en justifiant la réponse.

17/05/2014 C20_Synthese_arome_banane.doc 3/3
Table de données spectroscopiques IR
Liaison
Nombre d’ondes σ (cm-1)
Largeur
Intensité
O–H en phase gazeuse
3 590 – 3 650
fine
moyenne
O–H en phase condensée
3 200 – 3 400
large
forte
C–H
2 900 – 3 100
variable
moyenne à forte
O–H carboxyle
2 500 – 3 200
large
moyenne à forte
C=O ester
1 735 – 1 750
fine
forte
C=O carbonyle
1 700 – 1 740
fine
forte
C=O carboxyle
1 700 – 1 725
fine
forte
C=C
1 620 – 1 690
fine
moyenne
emprunte de la molécule
< 1 500
nombreuses bandes complexes
1
/
3
100%