Exemples de controle de systèmes chimiques pris dans l`industrie.

Lycée J-B Schwilgué - SELESTAT
GROSSHENY L.
Terminale S
Chapitre 12
Comment modifie-t-on l’évolution
d’un système chimique dans l’industrie ?
I. Par un choix judicieux des conditions expérimentales
II. Par un changement de réactif.
III. Par l’utilisation de la catalyse.
I. Par un choix judicieux des conditions expérimentales.
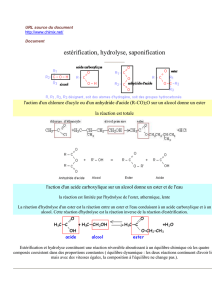
Les transformations associées à la réaction d'estérification entre un acide carboxylique et un alcool
et la réaction d'hydrolyse d'un ester sont lentes et limitées.
Nous avons vu en TP et en cours que des conditions expérimentales permettent de privilégier une
réaction, d’en augmenter le rendement et/ou la vitesse :
• Augmentation de la température
• Augmentation de la concentration d’un des réactifs
• Récupération d’un produit de la réaction
Ces méthodes impliquent un surplus de matière et d'énergie et augmentent donc le coût de
production des produits de ces réactions.
Pour réduire ces coûts de production, les chimistes ont alors réfléchi à un choix judicieux de réactifs
qui permettra d'obtenir les produits souhaités selon une transformation rapide et avec un meilleur
rendement. Ainsi, un réactif sera préférentiellement choisi s'il rend impossible la réaction inverse
qui limite le rendement de la transformation : la transformation devient alors totale et l'avancement
maximal est alors atteint
II. Par un changement de réactif.
1. Comment réaliser la synthèse totale d’un ester ?
• Écrire l’équation de la réaction d’un anhydride d’acide sur un alcool et de l’hydrolyse basique
d’un ester.
• Savoir que l’action d’un anhydride d’acide sur un alcool est rapide, qu’elle donne un ester et que
l’avancement maximal est atteint.
La réaction qui limite l’estérification est l’hydrolyse. Pour éviter cette réaction, il ne faut pas
produire d’eau.
Quel composer chimique utiliser ? un anhydride d’acide.
La formule générale d'un anhydride d'acide est :
Le nom anhydride (acide sans eau) provient du procédé
d’obtention : on élimine une molécule d'eau entre deux
molécules d'acide carboxylique :
Le nom s'obtient en remplaçant le mot acide de l’acide
carboxylique de départ par le mot anhydride.
L’anhydride d'acide est beaucoup plus réactif que l’acide carboxylique ; il réagit totalement
(on atteint l’avancement maximal) avec un alcool pour former un ester et un acide
carboxylique.

Lycée J-B Schwilgué - SELESTAT
GROSSHENY L.
La transformation associée à cette réaction est :
- plus rapide que celle mettant en jeu l’acide carboxylique et l’alcool
- totale, pour laquelle l’avancement maximal est atteint.
On explique cela par le fait que l’acide carboxylique formé ne réagit pas avec l’ester (la réaction
inverse n’a donc pas lieu). Contrairement à la synthèse d’un ester, l’ester est formé dans un milieu
anhydre puisqu’il ne se forme pas d’eau : la réaction d’hydrolyse qui limite le rendement n’a donc
pas lieu.
Une application industrielle : la synthèse de l’aspirine.
• Mettre en œuvre au laboratoire, en justifiant le choix du matériel à utiliser : chauffage à reflux,
distillation fractionnée, cristallisation, filtration sous vide, chromatographie sur couche mince
• Justifier les étapes d’un protocole
• Calculer le rendement d’une transformation.
Voir TP
Questions auxquelles ont doit pouvoir répondre :
• Quel système (distillation fractionnée, hydrodistillation, montage à reflux) va-t-on utiliser ?
• Quel procédé utilise-t-on pour réaliser la cristallisation de l’aspirine ?
• Qu’appelle-t-on filtration sous vide ? Expliquer le procédé.
• Comment réaliser une CCM ?
2. Comment réaliser l’hydrolyse totale d’un ester ?
• Écrire l’équation de la réaction d’un anhydride d’acide sur un alcool et de l’hydrolyse basique d’un ester.
• Savoir que l’hydrolyse basique d’un ester est rapide et que l’avancement maximal est atteint.
• Identifier la partie hydrophile et la partie hydrophobe d’un ion carboxylate à longue chaîne.
La réaction qui limite l’hydrolyse est l’estérification. Pour éviter cette réaction, il ne faut pas
produire d’alcool ou d’acide carboxylique. La réaction aves l’ion hydroxyde, très réactif produit un
ion carboxylate à la place de l’acide carboxylique correspondant.
L’hydrolyse basique.
L'hydrolyse basique d'un ester est la réaction de l'ion hydroxyde HO
-
avec cet ester. On obtient un
ion carboxylate et un alcool selon la réaction d'équation :
Cette réaction d'hydrolyse basique d'un ester (ou saponification) est une réaction assez rapide et
totale.
L'avancement final est égal à l'avancement maximal. Le taux d'avancement final est égal à 100 %.
La réaction d'hydrolyse basique d'un ester étant totale, elle peut être utilisée, dans l'industrie pour
préparer certains alcools et certains ions carboxylate qui, par acidification, pourront donner certains
acides carboxyliques.

Lycée J-B Schwilgué - SELESTAT
GROSSHENY L.
Remarque : l’hydrolyse basique a des caractéristiques différentes de l'hydrolyse d'un ester qui est
lente et limitée
Une application industrielle : la fabrication d’un savon : saponification.
3. Saponification.
Film « Savon de Marseille »
A chaud, on fait réagir de la soude concentrée sur un corps gras (huile, graisse : triglycérides ou
triesters du glycérol et d’acides gras dont le squelette comporte entre 12 et 22 atomes de carbone)
C’est quoi un corps gras ?
C’est un triester formé d'acide gras et du glycérol. Les corps gras sont encore appelés
triglycérides.
Le glycérol est un trialcool : le propan-1, 2, 3 -triol.
La fabrication d’un savon ( Power point).
Huile (corps gras)
Soude (milieu basique)
éthanol
Pierres ponces
Réfrigérant droit
Etape 1 : le montage à reflux.

Lycée J-B Schwilgué - SELESTAT
GROSSHENY L.
Etape 2 : le relargage
Contenu du ballon après le chauffage à reflux
Savon
Eau salée
Le savon précipite en présence d’eau salée (il devient solide et tombe au fond) => c’est le relargage.
On récupère le savon solide après séchage.
4. Les propriétés des savons.
La molécule de savon.
Le savon est un composé solide formé de différentes molécules de la famille des carbonates de
sodium ou de potassium : R-COONa
• La chaîne carbonée R est non ramifiée et possède plus de dix atomes de carbone.
• Le cation permet l’électro neutralité de la solution.
Dans l’eau on a la dissolution : RCOONa R-COO
-
+ Na
+
C’est l’ion carboxylate qui a les propriétés détergentes.
Dissolvons du savon dans de l’eau : on obtient une solution légèrement trouble.
•
Ajout d’acide : précipité blanc d’acide carboxylique
•
Ajout d’une eau dure (solution avec des ions calcium) : précipité blanc (trainées
blanche dans le bain)
•
Mesurons le pH de la solution : elle est basique
· Un savon n’agit presque plus dans une eau très calcaire car les ions carboxylate R – COO
-
constituants le savon précipitent avec l’ion Ca
++
:
· Un savon n’agit presque plus en milieu acide car une partie des ions carboxylate disparaît :
R – COO
-
(aq) + H
3
O
+
(aq) = R – COOH (aq) + H
2
O (liq)
· Un savon n’agit presque plus dans une eau salée comme l'eau de mer car, en présence des ions
Na
+
, l'équilibre suivant évolue vers la droite :
Le sel amène les ions Na
+
. Ces ions Na
+
font diminuer la quantité de savon RCOO
-aqueux
en
solution. Le milieu contient surtout RCOONa
solide
(grumeaux) inactif

Lycée J-B Schwilgué - SELESTAT
GROSSHENY L.
Action du savon.
L’ion carboxylate du savon possède une extrémité négative attirée par l'eau. On dit que cette
extrémité est hydrophile (amie de l'eau).
Cet ion carboxylate possède également une chaîne carbonée lipophile (amie des lipides ).
L'ion carboxylate possède donc une partie lipophile et une partie hydrophile On dit que c’est un
amphiphile (ami de l’un et l’autre).
Remarque : La partie hydrophile est évidemment lipophobe (peur des lipides) alors que la partie
lipophile est évidemment hydrophobe (peur de l'eau).
Exemple : Appliquons les considérations ci-dessus à un savon particulier :
• La formation de micelles (agrégats d’ions carboxylates) rend possible la dissolution dans l’eau
d’une tache d’huile présente sur un tissus. Cette tache d'huile se laisse pénétrer par la partie
lipophile (hydrophobe) du savon alors que la partie hydrophile entraîne la tache vers l’eau (voir
schéma ci-dessous). Une tache de terre (hydrophile) sera entraînée, elle, par une bicouche de savon.
III. L’utilisation des catalyseurs.
• Savoir qu’un catalyseur agit sélectivement lors d’une transformation.
1. Définition d’un catalyseur
Expérience
Introduire 20 mL de solution de peroxodisulfate de sodium dans un becher.
Ajouter 20 mL de solution d’iodure de potassium
• Observer.
Refaire la même expérience et ajouter quelques gouttes de catalyseur : nitrate de fer III.
• Observer et conclure sur le rôle du catalyseur.
En présence d’ions fer (III ), la vitesse de formation du diode est plus grande. Il se produit deux
nouvelles réactions :
réaction qui consomme des ions fer (III) : 2 Fe
3+
+ 2 I
-
Fe
2+
+ I
2
réaction qui les régénère : S
2
O
82-
+ 2 Fe
2+
2 SO
42-
+ 2 Fe
3+
Un catalyseur est une espèce chimique capable d’augmenter la vitesse d’une réaction
thermodynamiquement possible. Il n’intervient pas dans le bilan réactionnel.
 6
6
1
/
6
100%