JTA 2001 : Etude d`un traitement pharmacologique dans la

Etude d'un traitement pharmacologique dans la
mucoviscidose : premiers résultats du protocole
colchicine
G. Lenoir , J F. Duhamel , I. Sermet et M. Laurans
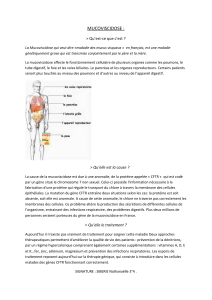
Depuis l'identification du gène de la mucoviscidose en 1989, des progrès considérables ont été accomplis
dans la connaissance de la structure et la fonction de la protéine CFTR . Les conséquences de ses
anomalies dans la fibrose kystique sont également mieux comprises. A partir d'observations cliniques faisant
état d'une amélioration significative de la fonction pulmonaire chez trois patients atteints de mucoviscidose
après une chimiothérapie anti-tumorale pour une pathologie associée, une nouvelle voie de la
physiopathologie de la mucoviscidose est née, issue d'une réflexion commune entre chercheurs
fondamentaux ( équipe du Pr JY Lallemand et celle d'A Edelmann à Necker ) et cliniciens ( équipe du Pr G
Lenoir ).
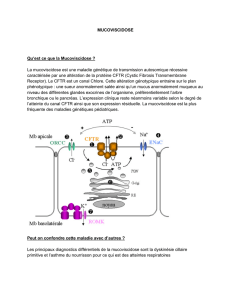
L'amélioration de ces patients pourrait être due à la substitution du CFTR déficient par d'autres protéines
ABC ( ATP binding cassette) telles MRP ( Multi Resistance Drug Associated Protein ) ou MDR stimulées par
la chimiothérapie ; CFTR ne serait plus considéré exclusivement comme un canal chlore mais comme
transporteur ABC ayant pour rôle principal en dehors de celui de transporteur trans-épithélial, un rôle
important de détoxification de la cellule associée au glutathion (1) . A partir de ces résultats, un essai de la
colchicine dans la mucoviscidose a été proposé.
Les résultats préliminaires
observés chez des enfants ou adolescents atteints de mucoviscidose traités en ouvert par la colchicine ont
été les suivants : 19 patients ( 5-28 ans ) atteints de mucoviscidose, présentant des infections pulmonaires
graves ou une obstruction respiratoire chronique, ont bénéficié d'un traitement par colchicine, à raison d'1 mg
par jour. Leur traitement habituel est resté inchangé. Le poids ( exprimé en déviation standard, DS , du poids
idéal pour l'âge), le volume expiratoire maximal seconde (VEMS), la capacité vitale forçée (CVF) et la durée
d'antibiothérapie ont été comparés avant et après une période minimale de six mois de traitement.
Tous les patients ont noté une amélioration de leur état clinique. La médiane du gain de poids était de 5% ( p
= 0.2 ).La médiane de la durée de l'antibiothérapie a diminué de façon significative, de 6.6 à 2.9 jours par
mois, après le début du traitement ( p = 0.05 ).En terme d' EFR, seuls 13 patients ont pu être analysés . Un
patient est resté stable tandis que 8 patients ont été améliorés de plus de 5% de leur VEMS et /ou de la CVF.
En l'absence de traitement, on observe habituellement une diminution régulière du VEMS au cours du temps.
Un patient a eu une très nette amélioration de sa fonction respiratoire ( augmentation de la CVF de 32 à 44%
et du VEMS de 21 à 37% ) qui a conduit à son retrait de la liste de transplantation pulmonaire. La colchicine
a été bien tolérée, à l'exception de deux patients qui ont présenté des troubles digestifs les premiers jours de
l'administration ( 2 ).
Ces premiers résultats encourageants ont conduit à la réalisation d'un essai prospectif de phase II,
1/4

randomisé en double aveugle dans les services du Pr G Lenoir (CHU Necker Paris) et du Pr JF Duhamel (
CHU Clémenceau Caen). Son objectif était d'évaluer l'efficacité de la colchicine versus placebo, sur la
fonction respiratoire de patients de plus de cinq ans atteints de mucoviscidose. L'évaluation clinique a été
complétée par la détection d'une activité des canaux chlore sur les cellules issues des brossages nasaux.
Dans cette étude, la colchicine est associée à la N Acétylcystéine, précurseur du glutathion.
Ce dernier joue un rôle essentiel dans le processus de détoxification cellulaire et est indispensable au
fonctionnement de MRP. L'accord du CCPRB de Necker a été obtenu. L'étude a bénéficié de l'aide du
Secrétariat d'état à la santé.
Patients et Méthodes
Les patients atteints de mucoviscidose (test de la sueur : Cl 60 mmol/l et/ou génotype confirmatoire) inclus
étaient suivis au CHU Necker Enfants Malades ou à Caen. Ils étaient âgés de plus de 5 ans et étaient
capables d'effectuer des EFR. Ils devaient avoir une fonction respiratoire stable à l'inclusion et présenter une
capacité vitale (CV) supérieure à 50 % de la théorique et un VEMS supérieur à 40 % de la théorique. Les
principaux critères d'exclusion étaient les suivants : absence d'atteinte pulmonaire, autre maladie évolutive
associée, insuffisance rénale, hépatique, cardiaque, antécédents digestifs (ulcère gastro-duodénal), diabète,
infection pulmonaire évolutive (aspergillose broncho-pulmonaire, mycobactéries atypiques, infection à
Burkholderia cepacia...) grossesse et cancer.
PERIODE 1
PREINCLUSION 2 TRAITEMENTS COMPARATIFS 3 SUIVI
Visites V1 V2 V3 V4 V5 V6 V7 V8 V9 V10 V11
Jours - 7 à - 28 0 INCLUSION 28 56 84 112 140 168 196 224 252
Examens (EX)
cliniques + + + + + + + + + + +
Antibiothérapie
et
hospitalisations
(nbre de jours)
+ + + + + + + + + + +
Qualité de vie + + +
Compliance + + + + + + + + + +
Evenements
indésirables + + + + + + + + + +
ECBC + + + +
EFR + + + + +
Examens
sanguins + + + +
Examens de
Recherche + (glutathion) + +
Score clinique
et radiologique + +
dosage de la
Colchicine +
TABLEAU I
Cette étude s'est déroulée en trois phases (tableau I ) ; 72 patients ont été inclus :
2/4

• Une première phase de pré-inclusion dite de " stabilisation " (V1) au cours de laquelle le protocole est
expliqué, le consentement est signé par les deux parents ou l'adulte , les antécédents médicaux
consignés et un prélèvement sanguin est réalisé (dosage du glutathion). Le traitement par
N-Acétylcystéine est débuté et sera poursuivi tout au long de l'étude.
• Une phase de " traitements comparatifs " (période en double aveugle) :
• 6 mois de Colchicine : 1 mg le soir (0.5 mg la première semaine de traitement). ou 6 mois de placebo.
La visite d'inclusion (V2) inclue un examen clinique complet , des prélèvements sanguins (NFS plaquettes,
ionogramme sanguin, VS, électrophorèse des protides, bilan hépatique, glutathion), un ECBC, des EFR et un
frottis nasal pour étude de l'expression protéique de P-gP, MRP et CFTR. Une visite analogue aura lieu au
troisième et sixième mois (V8). Entre ces visites, le patient est vu mensuellement en consultations externes
dans le service du Professeur LENOIR à Necker Enfants Malades et dans le service du Professeur
DUHAMEL au CHU de Caen.
Le principal critère d'efficacité est l'amélioration du VEMS de plus de 7.5% par rapport au niveau de base du
patient. Les critères secondaires d'appréciation sont : - des paramètres cliniques : poids (DS), taille (DS ),
activité (score de Shwachman), qualité de vie, nombre de jours d'antibiothérapie (per os ou IV) et
d'hospitalisation - et des paramètres paracliniques :
• amélioration de la CVF, du DEM 25-75.
• diminution de la colonisation bronchique.
• amélioration du score radiologique.
• induction protéique : ú expression de l'ARN messager des protéines MDR, MRP et CFTR au sein des
cellules ciliées nasales, ú mesure du glutathion intracellulaire, ú mesure de l'activité oxydative des
polynucléaires neutrophiles.
Ces données ont été comparées à celles précédant le début du traitement par méthode de l'analyse de
variance ( ANOVA) à un facteur répété permettant de mettre en évidence une différence significative, si elle
existe, entre les moyennes dans leur ensemble. Les résultats ont été interprétés comme significatifs, lorsque
le risque était inférieur à 0.05. En complément, nous avons dénombré les journées d'antibiothérapie et
d'hospitalisation avant et après traitement et, apprécié la tolérance clinique et biologique. Les patients
présentant des troubles digestifs de plus d'une semaine sous régime d'exclusion lactée en début de
traitement ont été sortis de l'étude. Nous avons également évalué l'observance en comptabilisant le nombre
de gélules retirées à la Pharmacie centrale des hôpitaux de Paris et à celle de Caen et le nombre de gélules
restantes. L'analyse des résultats a été effectuée à l'aide de tests paramétriques.
L'étude est maintenant terminée et son analyse statistique est en cours. Les résultats détaillés seront
exposés lors de la réunion des JTA le 17/01/ 2001.
Conclusion
Depuis 1995, le pronostic de la mucoviscidose qui atteignait alors une médiane de survie de 35 ans dans les
meilleurs centres de traitement, n'a que très peu évolué.
Pour des raisons techniques, les espoirs de thérapie génique ne se sont pas confirmés.
Dans ces conditions, en complément de l'ensemble des propositions thérapeutiques dûment validées, il est
apparu légitime d'envisager des thérapeutiques à visée anti-inflammatoire, voire des thérapies de
substitution.
3/4

C'est dans ces conditions qu'une première étude de phase II avec la colchicine a été proposée, à partir des
résultats encourageants d'une étude ouverte.
Il est probable que les bénéfices éventuels seront différents en fonction des sujets et de leur type de
mutation. Les résultats détaillés indiqueront si cette voie peut être considérée comme justifiée, si d'autres
thérapeutiques pourront être ajoutées ou substituées à la colchicine.
Bibliographie
1) CLEMENT A, TAMALET A, FAUROUX B, TOURNIER G. Mucoviscidose : les stratégies thérapeutiques se
multiplient. Arch Pediatr 1998 ; 5 : 1246-52.
2) LENOIR G, SERMET I, SORIN M DUHAMEL JF, CHRETIENNOT C, GUILLERM JC, SCHERMANN JM .
Interest of colchicine in cystic fibrosis patients XIIIth International Cystic Fibrosis Congress Stockholm 2000 ,
Abstract 102 : 115.
*CHU Clémenceau Caen, **CHU Necker-Enfants Malades Paris - France
4/4
1
/
4
100%