Sur la voie de l`intuition? Théorème de Bayes et diagnostic en

PRAXIS Forum Med Suisse Nr. 3 17 janvier 2001 46
Introduction
Nous avons montré dans la première partie de
cet article que l’application du théorème de
Bayes en matière de diagnostic pouvait consti-
tuer un soutien rationnel de l’intuition. Nous
avons expliqué à l’exemple de l’agriculteur avec
présomption d’appendicite les règles valables
dans le diagnostic différentiel pour l’acquisition
d’informations. Outre la sensibilité et la spéci-
fité, nous avons également exposé les avan-
tages du coefficient de probabilité en tant que
paramètre objectif de la performance d’un test.
Nous décrivons ci-dessous comment le théo-
rème de Bayes est susceptible d’enrichir quan-
titativement le diagnostic, et cela dans la pers-
pective du potentiel représenté par une banque
de données diagnostiques aisément accessible
aux médecins généralistes.
Un agriculteur souffre de
douleurs abdominales: quelle est
la probabilité d’une appendicite?
Dans le cas de notre agriculteur, comment par-
venir, à l’aide du théorème de Bayes, à la pro-
babilité post-test d’une appendicite? La pre-
mière étape consiste à évaluer la probabilité
avant test d’une appendicite. Wagner et al [4]
ont montré que dans la pratique ambulatoire,
la prévalence de cette maladie chez les adultes
présentant des douleurs abdominales se situe
entre 0,7 et 1,6% (tab. 1). La prévalence de
l’appendicite chez les patients souffrant de dou-
leurs abdominales aiguës ne revêt aucune si-
gnification dans notre cas, parce que la défini-
tion «aiguës» présuppose déjà l’utilisation de
tests cliniques. Versons la prévalence de 1%
dans l’«entonoir» du premier «transformateur
de probabilité», à savoir le premier test (fig. 1).
Afin de caractériser ces transformateurs de
probabilité, nous avons besoin maintenant
d’informations sur les qualités de test de
l’anamnèse, des résultats des examens cli-
niques et des résultats de laboratoire.
Ces qualités sont réunies dans le tableau 2, à
ceci près que seuls sont indiqués les coefficients
de transformation de probabilité et qu’on a re-
noncé à la citation de la sensibilité et de la spé-
cificité. L’exemple des vomissements montre
clairement que l’existence d’un symptôme peut
présenter un CP+ inférieur à 1. Des vomisse-
ments cités dans l’anamnèse réduisent ainsi la
probabilité d’une appendicite. On remarquera
que seule la mention de douleurs dans la zone
de l’abdomen inférieur droit avec un CP+ de 7
apporte, en tant que test isolé,un complément
d’information essentiel. Une certaine numéra-
tion de leucocytes ainsi que de la fièvre sont
cités à titre de paramètres de l’inflammation
(tab. 3). La protéine C-réactive et la vitesse
de sédimentation du sang fournissent des per-
formances de test de qualité inférieure. Dans la
mesure où ces paramètres ne sont pas dicho-
tomiques, la distinction en CP+ et CP– est in-
utile. Ceci met en lumière un autre avantage du
coefficient de probabilité: le potentiel informa-
tif d’un test peut être optimisé par le calcul des
CP pour différentes valeurs limites d’un test.
Seules les numérations de leucocytes de plus
de 15×109/L peuvent être considérées comme
expressives à titre de test isolé.
Dans le cas de notre agriculteur souffrant de
douleurs abdominales, les indications sui-
vantes sont donc exploitables à titre de tests
pour une appendicite (pour simplifier, les va-
leurs ont été arrondies): (I) Douleurs dans l’ab-
domen inférieur droit (CP+ = 7.3); (II) Migration
de la douleur dans l’abdomen inférieur droit
(CP+ = 3.2); (III) Douleur d’un genre nouveau,
jamais encore éprouvée (CP+ = 1.5) et (IV)
la Leucocytose de 13×109/L (LR+ = 2.4). La
probabilité avant test d’environ 1% (tab. 1)
est ainsi modifiée par plusieurs tests qui peu-
vent être considérés comme séquence de
«transformateurs de probabilité» (fig. 1). Le
test de la nouveauté du type de douleur qui,
considéré isolément, serait peu expressif avec
Sur la voie de l’intuition?
Théorème de Bayes et diagnostic
en médecine générale
Partie II
D. Pewsnera, J. P. Bleuerb, H. C. Bucherc, M. Battagliad, P. Jünid,e, M. Egger d,f
aPraxis für Innere Medizin FMH,
Bern
bMediscope AG, PF, 3000 Bern 23
cMedizinische Universitäts-
Poliklinik, Kantonsspital, Basel
dInstitut für Sozial- und Präventiv-
medizin, Universität Bern
eRheumatologische Universitäts-
klinik, Inselspital, Bern
fDivision of Health Services
Research, Department of Social
Medicine, University of Bristol
Correspondance:
Dr Daniel Pewsner
Case postale
CH-3000 Berne 26
469-00 Praxis f

PRAXIS Forum Med Suisse Nr. 3 17 janvier 2001 47
un CP+ de seulement 1,5, peut aussi être judi-
cieusement intégré en qualité de chaînon à une
telle «chaîne de test». La probabilité post-test
du test précédent correspond en l’occurrence à
la probabilité avant test du test suivant. L’im-
portant est que des grandeurs de test indépen-
dantes les unes des autres soient prises en
compte. Ainsi serait-il erroné de combiner les
paramètres de l’inflammation que sont la fièvre
et la leucocytose. Nous devons bien plus nous
limiter à ceux des paramètres de l’inflamma-
tion qui présentent de meilleures performances
de test. Le coefficient de probabilité de toute la
série de tests résulte du produit du coefficient
de chacun des tests utilisés dans cette série:
Coefficient de probabilité total = 7,3 ×3,2 ×1,5
×2,4 = 84
Cette constellation de résultats de tests se trou-
vera être ainsi 84 fois plus probable chez les pa-
tients souffrant d’une appendicite aiguë que
chez les patients sans inflammation de l’ap-
pendice. Connaissant la probabilité avant test
d’environ 1% et le coefficient de probabilité de
84, la probabilité post-test peut être calculée.
Ceci en changeant d’«unité» pour passer de
celle des pourcentages de la probabilité avant
test à celle des Odds, en multipliant ces Odds
avant test par 84 et en retranscrivant ensuite
les Odds de post-test à nouveau en pourcentage.
Ce travail fastidieux nous est facilité par le
Nomogramme Fagan [17] (fig. 2): avec son
aide et par l’intermédiaire du coefficient de
probabilité, on parvient directement à la pro-
babilité post-test en se basant sur la probabilité
avant test. La probabilité avant test de 1% est
recherchée sur l’échelle de gauche et une ligne
est tracée à l’aide d’une règle jusqu’au coeffi-
cient de probabilité 84 sur l’échelle du milieu.
Il est alors possible de lire la valeur de la pro-
babilité post-test sur l’échelle de droite: elle
est d’environ 45% (fig. 2). Parce que les
groupes de patients examinés présentent une
prévalence de l’appendicite plus élevée qu’en
médecine générale, les coefficients de probabi-
lité ont sans doute été plutôt surestimés (biais
de profil, voir tab. 5). De manière plus réa-
liste, la probabilité post-test devrait se situer
entre 35 et 45%, une valeur correspondant
vraisemblablement à la probabilité intuitive-
ment estimée par le lecteur. Mais intuition et
probabilité calculée ne sont pas toujours iden-
tiques. Ainsi, nombreux seraient sans doute les
médecins qui auraient tendance à surestimer la
probabilité d’une embolie pulmonaire chez un
patient en état post-critique après mise en place
d’une prothèse de la hanche, avec symptoma-
tologie et résultats typiques (voir tab. 6).
Comment continuer? La signifi-
cation de la probabilité post-test
Quelle est la probabilité post-test qui doit être
exigée pour qu’un diagnostic puisse être posé
respectivement exclu dépend de nombreux fac-
teurs. Insistons rapidement dans ce contexte
sur le concept des seuils de décision [1, 3, 5].
«Poser un diagnostic» implique que nous trai-
tions un patient comme si la maladie corres-
pondante était présente, même si la probabilité
que la maladie soit réellement donnée n’atteint
pas 100%. Le «seuil de test thérapeutique» dé-
finit le seuil de probabilité de la maladie auquel
les deux options «examens supplémentaires» et
«thérapie» sont équivalentes. En cas de dépas-
sement de cette valeur-limite, le diagnostic est
posé et par conséquent le traitement induit,
alors que si ce seuil-limite n’est pas atteint,
d’autres examens sont effectués, jusqu’à ce que
le «seuil de test thérapeutique» soit dépassé
quand même ou que le résultat obtenu se situe
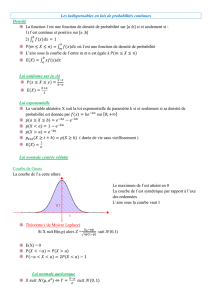
Figure 1.
Une cascade de transformateurs de probabilité modifie la probabilité avant test, la probabi-
lité post-test du test précédent correspondant en l’occurence à la probabilité avant test
du test suivant. La cascade peut être considérée dans sa globalité comme un test dont le
coefficient de probabilité (Likelihood Ratio) correspond au produit du coefficient de proba-
bilité des différents tests. L’utilisation mathématique de cette cascade est autorisée égale-
ment si les tests ne sont pas effectués l’un après l’autre dans l’ordre indiqué.

PRAXIS Forum Med Suisse Nr. 3 17 janvier 2001 48
en dessous du «seuil non thérapeutique de
test». Cette deuxième valeur-limite indique que
les deux possibilités «examens supplémen-
taires» et «pas de thérapie» sont équivalentes.
Si le résultat obtenu se situe en dessous de cette
valeur, on n’induit ni traitement ni examens
supplémentaires, le diagnostic est considéré
comme exclu. Un test n’est donc vraiment judi-
cieux que si nous nous trouvons dans le «no
man’s land» du domaine de ce test et qu’une
chance existe par ailleurs que ce test nous
amène dans la zone située au-delà du «seuil de
test thérapeutique» (traitement) ou au-delà du
«seuil de test non-thérapeutique» (pas de trai-
tement).
Dans le cas de notre agriculteur, avec une
probabilité post-test de 35 à 45%, l’indication
d’une opération n’est pas donnée. Mais cette
probabilité post-test ne nous autorise cepen-
dant pas à renvoyer chez lui le patient rassuré.
Nous nous trouvons encore dans le «no man’s
land» entre les deux seuils de décision. Bien au
contraire, l’utilisation d’autres tests présentant
un potentiel nous permettant de franchir l’un
ou l’autre seuil s’impose donc. L’utilisation ci-
blée du test de l’épreuve du temps (Test of Time)
sans hospitalisation (dont les caractéristiques
sont difficiles à évaluer) dépend non seulement
de la préférence du patient et de l’éloignement
de l’hôpital mais également de la disponibilité
d’autres ressources diagnostiques. Ainsi, la so-
nographie abdominale (sensibilité = 76%, spé-
cificité = 91%, CP+ =8, CP– = 0.25 [7]) et bien
plus encore la tomodensitométrie de l’appen-
dice (sensibilité = 96%, spécificité = 89%, CP+
=9, CP– = 0.04 [7]) resp. la tomodensitométrie
hélicoïdale avec injection de substance de
contraste (sensibilité = 98% et spécificité =
98%, CP+= 48, CP–= 0.02 [8]) peuvent consti-
tuer des étapes supplémentaires permettant
des économies de temps et de coûts. La tomo-
densitométrie, grâce à sa sensibilité élevée,
remplit les conditions d’un test SnNout (voir en-
cadré 1): un résultat négatif exclut une appen-
dicite avec une grande fiabilité, si la probabilité
avant test n’est pas très élevée. La tomodensi-
tométrie hélicoïdale avec injection satisfait
même les critères d’un test SnNout et SpPin
(tab. 4). Dans notre cas, après un entretien
détaillé en présence de sa femme, le patient est
autorisé à rentrer chez lui, sous réserve de
contrôles quotidiens. Le deuxième jour, les dou-
leurs abdominales ont nettement diminué, le
patient est tout à fait rétabli après une semaine.
Le test de l’«épreuve du temps» a conduit à
l’exclusion d’une appendicite (nécessitant un
traitement).
Tableau 1.
Probabilité avant test (prévalence) de l’appendicite.
Collectif de patients Probabilité avant test
Domaine ambulatoire: adultes présentant des douleurs 0,7–1,6%
abdominales
Pavillon des urgences: patients de moins de 60 ans 12–26%
présentant des douleurs abdominales aiguës
Pavillon des urgences: patients de plus de 60 ans 4%
présentant des douleurs abdominales aiguës
Source: Wagner et al [4]
Tableau 2.
Anamnèse et examen clinique de l’appendicite aiguë.
Coefficient de probabilité pour
la présence d’un symptôme
ou d’un résultat (CP+)
Indications anamnestiques et symptômes
Douleur dans l’abdomen inférieur droit 7.31
Douleur d’un genre nouveau 1.50
Douleur avant vomissements 2.76
Migration de la douleur dans l’abdomen inférieur droit 3.18
Inappétence 1.27
Nausée 1.20
Vomissements 0.92
Résultats de l’examen
Défense 3.76
Psoïtis 2.38
Douleur au relachement de la pression abdominale 6.30
Douleur au point de Douglas 5.34
Fièvre (rectale) Voir tableau 3
Source: Wagner et al [4]
Tableau 3.
Performance de tests des paramètres de l’inflammation
en cas d’appendicite.
Paramètres de l’inflation Coefficient de probabilité
Numération des leucocytes (109/L)
<8,0 0,16
8 bis ≤10 0,83
10 bis ≤12 1,12
12 bis ≤15 2,44
>15 7,03
Température rectale en °C
<37,7 0,44
37,7–37,9 1,61
38,0–38,4 1,77
≥38,5 3,01
Source: Andersson et al [16]

PRAXIS Forum Med Suisse Nr. 3 17 janvier 2001 49
Un pas de plus sur les traces
de l’intuition: une «Collaboration
Bayes» est-elle nécessaire?
La connaissance de la prévalence de maladies
ainsi que la performance de l’anamnèse, des
signes cliniques et des tests en matière de diag-
nostic constituent des outils précieux pour la
pose d’un bon diagnostic. Les grands secrets de
l’art médical ne nous sont bien entendu pas ré-
vélés pour autant. Le théorème de Bayes nous
permet de franchir un pas de plus sur la voie
de l’intuition, par définition difficilement sai-
sissable et sujette à erreur, en donnant à celle-
ci un fondement plus rationnel. Mais il ne doit
ni ne peut remplacer le fruit d’une expérience
de longues années.
A l’heure actuelle, les médecins généralistes et
les spécialistes profitent peu de Thomas Bayes,
dans la mesure où les informations nécessaires
et les caractéristiques des tests ne sont pas dis-
ponibles sous forme claire et rapidement acces-
sible. Idéalement parlant, l’élaboration et l’en-
tretien d’une telle banque de données devrait
être entreprise sous forme de «Collaboration
Bayes», de manière analogue à la «Cochrane
Collaboration», par un réseau international de
spécialistes intéressés [9]. La recherche systé-
matique et aussi complète que possible ainsi que
la sélection critique des articles sur la qualité des
tests et la prévalence constituent la base de l’éla-
boration de la banque de données planifiée.
Sont essentiels en l’occurrence pour la sélection
des études leur qualité méthodologique et leur
signification pour les médecins généralistes.
Dans un aperçu d’ensemble de la littérature
consacrée au diagnostic dans des revues médi-
cales de haut niveau (N Engl J Med, JAMA, Br
Med J et Lancet 1990–93), seules 18% des
études examinées répondaient aux exigences
méthodologiques de base [6] (voir tab. 5). 30%
des travaux examinés par Lijmer et al [10] en
1996–97 répondaient cependant à des critères
analogues. C’est pourquoi il est permis de sup-
poser que la méthodologie s’est améliorée au
cours de ces dernières années.
Dans le cadre d’un projet pilote soutenu par
l’Académie Suisse des Sciences Médicales, nous
avons commencé les travaux d’élaboration
d’une banque de données diagnostiques pour
médecins généralistes: l’objectif est d’inclure
des maladies fréquentes et jouant un rôle im-
portant au quotidien. Citons à titre d’exemple
la thrombose veineuse profonde, l’infarctus du
myocarde, l’angine de poitrine chronique, l’em-
bolie pulmonaire aiguë, la pneumonie, la sinu-
site aiguë, la méningite, les céphalées et les
douleurs dorsales. Le but est de mettre à la dis-
position des praticiens et des cliniciens un outil
qui leur permette d’améliorer les processus de
diagnostic dans l’assistance des patients. La
banque de données doit être accessible par voie
électronique. Il est prévu d’étendre ce fichier et
de le maintenir à jour par l’inclusion perma-
nente d’études nouvellement parues. Il s’agit
d’une entreprise de longue haleine, c’est pour-
quoi nous sommes très intéressés par les
suggestions et la collaboration d’autres prati-
cien(ne)s et clinicien(ne)s.
Remerciements
Nous tenons à remercier les docteurs A. Jaggi
et Ch. Junker, Berne, de la lecture critique de ce
manuscrit.
Nomogramme pour l’interprétation
de tests diagnostiques
Probabilité avant test
Probabilité post-test
Coefficient de probabilité
(Likelihood Ratio)
Figure 2.
Connaissant la probabilité avant test en pour-cent
et le coefficient de probabilité du ou des test(s) uti-
lisé(s), il est possible de lire directement la probabi-
lité post-test en pour-cent à l’aide du «nomogramme
de Fagan» [17].
Celui-ci permet d’éviter le calcul en Odds. Dans le cas
de l’agriculteur souffrant de douleurs abdominales,
la probabilité avant test est de 1% et le coefficient de
probabilité du test utilisé est de 63. On obtient donc
une probabilité post-test de 40%.

PRAXIS Forum Med Suisse Nr. 3 17 janvier 2001 50
Tableau 4.
«SpPins» et «SnNouts».
On peut déduire de la définition de la sensibilité la règle approximative selon laquelle un test négatif de sensi-
bilité élevée (faible taux faux négatif) permet l’exclusion d’une maladie recherchée (p. ex. D-Dimères [ELISA]
lors de la recherche d’une embolie pulmonaire), mais n’autorise par contre pas l’«inclusion» en présence d’un
résultat positif. Pour être plus explicite, imaginons un pêcheur qui utilise un filet aux mailles très serrées
(= sensibilité élevée), afin de ne pas laisser échapper les poissons de petite taille. Il doit par contre accepter le
risque de récolter une grande quantité de déchets dans son filet (un filet lourd ne doit pas induire la conclusion
qu’un poisson a été pris). Cette règle est souvent appelée «SnNout» dans la littérature anglo-saxonne
[2, 15].
«SnNout»: «Sensitivity Negative rule the target disorder out»: un résultat de test négatif d’un test de sensibilité
élevée permet l’exclusion d’une maladie.
Inversement, la règle approximative selon laquelle un test positif de sensibilité élevée (faible taux faux positif)
permet l’inclusion d’une maladie recherchée (p. ex. mise en culture de salive Tbc positive), mais n’autorise par
contre pas son exclusion en présence d’un résultat négatif. De tels résultats sont également appelés «patho-
gnomoniques». Un filet aux mailles larges ou mieux une nasse permet certes à de nombreux poissons de
s’échapper, mais la probabilité est cependant élevée que lors d’une prise rare, un poisson recherché soit réel-
lement capturé. On parle alors de «SpPin».
«SpPin»: «Specificity Positive rule the target disorder in»: un résultat de test positif d’un test de spécificité éle-
vée permet l’inclusion d’une maladie.
Ajoutons à titre limitatif que le potentiel informatif d’un test – qu’il s’agisse d’exclusion ou d’inclusion –
dépend à la fois de la sensibilité et de la spécificité. C’est pourquoi les règles de «SnNout» et de «SpPin» ne
sont valables que si la spécificité respectivement la sensibilité correspondante ne se situent pas au dessous de
40 à 50%; une condition que remplissent d’ailleurs la plupart des tests usuels.
Tableau 5.
Distorsions lors de l’évaluation de tests diagnostisques: biais de profil (du patient),
biais de vérification, biais de révision.
Chez les populations présentant une fréquence élevée d’une certaine pathologie, les stades avancés de cette
maladie sont également plus fréquents, d’où une amélioration potentielle de la sensibilité des tests (moins de
faux négatifs) [10, 11]. Ce phénomène est désigné par le terme de «biais de profil» (Spektrumbias). La trans-
formation du profil du patient peut également exercer une influence sur la présence d’autres maladies impor-
tantes du point de vue du diagnostic différentiel, ce qui modifie la spécificité (nombre de faux positifs). Les qua-
lités de test présentées dans le texte principal pour les symptômes et les résultats viennent de patients qui ont
été admis aux urgences en raison d’une présomption d’appendicite. La plupart ont donc franchi la barrière de
la médecine générale et présentent en conséquence une probabilité avant test respectivement une prévalence
de l’appendicite plus élevée.
Dans le cas de l’appendicite, mais également pour d’autres maladies, se pose le problème de l’application du
standard de référence, dans ce cas de l’opération avec examen histologique. Dans le cas d’un design idéal de
l’étude, le diagnostic établi avec l’aide du standard de référence devrait se vérifier chez tous les patients. Parce
que la responsabilité d’une opération ne peut être prise dans le cas d’une appendicite qu’en présence d’une
présomption d’urgence, un diagnostic négatif ne sera donc pas vérifié. C’est par contre un test de référence su-
bordonné au standard de référence (p. ex. «Test of Time») qui sera utilisé. Ce qui peut conduire à un biais de
vérification [13, 14].
Lors de la comparaison de la performance d’un nouveau test avec celle du test de référence, les résultats doi-
vent être évalués indépendamment les uns des autres. Les personnes qui évaluent les résultats d’un nouveau
test devraient ne rien connaître du standard de référence [10]. Sans quoi le danger d’un «embellissement»
de la sensibilité et de la spécificité du nouveau test existe, dans la mesure où l’expérience montre que nous dé-
celons mieux les choses lorque que nous savons ce que nous devons chercher et où nous devons le faire. En
ce qui concerne l’appendicite, ce phénomène appelé biais de révision joue surtout un rôle pour les procédés
fournisseurs d’images de la sonographie et de la tomodensitométrie.
 6
6
 7
7
1
/
7
100%