A- HYDROCAR et HALO _Enregistré

29
Pr Amidou DOUCOURE: FAST-Université de Bamako. MALI & Dr Bakary KEÏTA: DER P/C-E.N.Sup. Bamako MALI
2
LES FONCTIONS ORGANIQUES

30
Pr Amidou DOUCOURE: FAST-Université de Bamako. MALI & Dr Bakary KEÏTA: DER P/C-E.N.Sup. Bamako MALI
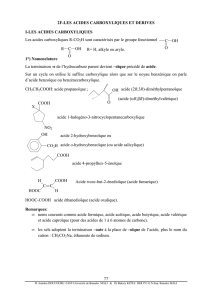
2A-LES HYDROCARBURES ET DERIVES HALOGENES
Les hydrocarbures sont des composés organiques constitués uniquement de C et de H
(alcanes, alcènes, alcynes et benzéniques). La substitution d’un H (ou de plusieurs) par un X
(ou plusieurs) sur un hydrocarbure conduit aux dérivés halogénés.
I-LES ALCANES: hydrocarbures saturés ou paraffines (peu réactifs) de formule brute
C
n
H
2n+2
(acycliques) et C
n
H
2n
(monocycliques).
Ils sont représentés par R-H, R étant le groupe alkyle (ou alcoyle).
1°) Nomenclature
Selon l’IUPAC, le nom est formé par la juxtaposition : où le préfixe
exprime la nature et le nombre de groupes alkyles par ordre alphabétique installés sur le squelette
de base ainsi que leur emplacement ; le radical rend compte du nombre de C du squelette de
base ; le suffixe ane est caractéristique des alcanes.
Remarques:
• les alcanes non ramifiés n’auront pas de préfixe
• les alcanes à ramifications ramifiées auront des préfixes complexes (groupes alkyles
substitués).
• la multiplicité des groupes alkyles simples est marquée par di, tri, tétra,… pour 2, 3, 4,
… groupes identiques (sans préjudice sur l’ordre alphabétique). Quant aux groupes
alkyles ramifiés, leur nom est mis entre parenthèses et leur multiplicité est marquée
par bis, tris, tétrakis, … pour 2, 3, 4, … groupes identiques (sans préjudice sur l’ordre
alphabétique).
• les stéréodescripteurs ( R/S, E/Z, cis/trans, érythro/thréo, méso, +/-, D/L…) sont
placés en italique et entre parenthèses suivis d’un tiret devant le nom de
l’hydrocarbure.
2°) Accès
• alcènes ou alcynes par hydrogénation (t°, Pt ou Ni)
• dérivés halogénés R-X par Würtz (2Na) ou hydrogénation en présence de Pd
conduisant respectivement à R-R ou R-H.
• décarboxylation de R-CO
2
H (NaOH, t°)
• Autres méthodes d’accès :
Préfixe RADICAL ane
RX R MgX R H +MgXOH
Mg H OH
C O CH
2
(Clemmensen ou Wolf-Kishner)
Zn, H , t°
H
2
N NH
2
, OH, t°
ou

31
Pr Amidou DOUCOURE: FAST-Université de Bamako. MALI & Dr Bakary KEÏTA: DER P/C-E.N.Sup. Bamako MALI
3°) Caractéristiques physiques
Peu solubles dans l’eau avec des points de fusion inférieurs à 100°C et des densités de l’ordre
de 0,7.Les températures d’ébullition diminuent avec la ramification et augmentent avec la
cyclisation.
• en IR, C-C absorbe autour de 1000cm
-1
et C-H entre 2850 et 3000cm
-1
.
• en
1
H-RMN les déplacements chimiques de C-H sont de l’ordre de 1ppm.
C
1,54 A
°
1,10 A
°
109,5°
C
H
4°) Réactivité
Par cassure des liaisons σ (C-C lors des réactions de combustion et C-H lors des réactions de
substitution, respectivement pour 350 et 400 kJ.mol
-1
)
Cl
2
est plus réactif que Br
2
mais moins sélectif lors des S
R
.
Remarques:
• les agents d’halogénation plus commodes sont : le chlorure de sulfuryle (SO
2
Cl
2
), le
chlorure de sulfonyle (SOCl
2
) et le NBS :
• les réactions à chaud (autoxydation, nitration, sulfonation, alkylation, craquage,
isomérisarion, hydroformage et méthylénation) peuvent être mentionnées comme
réactions de fonctionalisation ou d’alkylation :
CH
X
2
,hνO
2
CO
2
+ H
2
O +Q kJ
CX
HX +
N
O
O
Br
+
O O
-H
2
O
R H R O OH
R H +HO NO
2
R NO
2
RH + HO SO
3
H-H
2
ORSO
3
H
RH
+
CH=CH
2
R' CH
R'
RCH
3
(Ipatieff)

32
Pr Amidou DOUCOURE: FAST-Université de Bamako. MALI & Dr Bakary KEÏTA: DER P/C-E.N.Sup. Bamako MALI
II-LES ALCENES: ou éthyléniques ou oléfines, non cycliques à une seule double
liaison, ils ont pour formule brute C
n
H
2n
.
1°) Nomenclature
La terminaison –ane de l’alcane correspondant devient -ène. On affecte un indice de
localisation de la double liaison(le plus petit) sur le squelette de base (le plus long et le plus
ramifié).
Remarques:
• les alcènes à 2,3,…doubles liaisons sont des alcadiènes,alcatriènes,…en affectant les
plus bas indices aux insaturations
• les groupes correspondants sont les alcényles :
• vinyle et allyle sont des noms de groupes courants :
• les alcènes cycliques sont des cycloalcènes ou cyclènes.
2°) Accès
par des réactions d’élimination :
C
20
H
42
C
10
H
22
+ C
10
H
20
t°ou H
+ 4H
2
R
3
C-H + CH
2
N
2
R
3
C-CH
3
+ N
2
CH
3
CH CH CH
2
CH
2
CCH
3
But-2-ényle isopropényle
CH
2
=CH- vinyle (éthènyle) et CH
2
=CH-CH
2
- allyle (prop-2-ényle ou 2-propényle)
Me C C
H
Me
CH
2
OH
H H C CH
Me
Me
CH
3
+
H ou Al
2
O
3
,t°
-H
2
OCH
Me
Me CH CH
2
(Zaïtsev)
(Hoffmann)
C C
H
X
Base
-HX
C C
X X
Zn
-ZnX
2
(trans-E) (cis-E)

33
Pr Amidou DOUCOURE: FAST-Université de Bamako. MALI & Dr Bakary KEÏTA: DER P/C-E.N.Sup. Bamako MALI
par réduction (acétyléniques, carbonylés)
par synthèse magnésienne :
par pyrolyse (esters, aminesIII/base) et craquage des alcanes
dans la nature on rencontre les terpènes, les stéroïdes et les phéromones.
3°) Caractéristiques physiques
• UV : C=C , 171nm
• IR : C=C , 1620 - 1680cm
-1
; de 3050 - 3150cm
-1
; H-C cis ,de 665 à
730cm
-1
; H-C trans , 960 – 980cm
-1
•
1
H-RMN : 4,5 – 5,7ppm
H
1,33 A
°
1
2
1
,
7
°
116,6 ° C C
HH
H
1,08 A
°
4°) Réactivité
simple liaison double liaison triple liaison
0,154 0,135 0,120 longueur (nm)
350 450/
σ + 27
0/
π=720
960 énergie (kJ.mol
-
1
)
La rupture relativement facile de la liaison π explique la disponibilité vis-à-vis des A
E
surtout
si les carbones doublement liés ont des substituants donneurs d’électrons.
C C H
2
,Pd/BaSO
4
ou Na/NH
3
liquide
CH CH (cis- ou trans-hydrogénation)
C O + H
2
CPΦ
3
−Φ
3
P=O C CH
2
(Wittig)
ylure de P
CH
2
=CH-CH
2
X + XMg-R CH
2
=CH-CH
2
-R
-MgX
2
HC
HC
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
1
/
18
100%