Ex 19p192 a. La configuration électronique de l`oxygène est la

Ex#19p192#
THÈME#:#UNIVERS/TABLEAU#PÉRIODIQUE#!
!
#
#
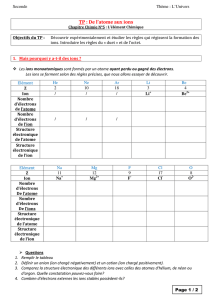
a.#La#configuration#électronique#de#l’oxygène#est#la#
suivante#:#(K)2(L)6.#
pour#satisfaire#à#la#règle#de#l’octet#l’oxygène#
capture#8W6=#2#électrons#pour#former#l’ion#oxyde#
forme#l’ion#O2W.#
b.#Mg#est#situé#sur#la#deuxième#colonne#du#tableau#
périodique#il#possède#donc#deux#électrons#
périphériques#et#sur#la#troisième#ligne#sa#couche#
électronique#externe#est#donc#la#couche#M##
pout#satisfaire#la#règle#de#l’octet#il#perd#ses#deux#
électrons#périphérique#afin#que#la#couche#
électronique#externe#de#l’ion#magnésium#soit#la#
couche#L#laquelle#comporte#alors#8#électrons#
périphérique#pour#former#l’ion#Mg2+.#
#
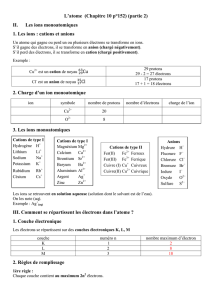
c.#la#magnésie#bien#que#constituée#d’ions#doit#être#
globalement#électriquement#neutre#elle#renferme#
des#ions#O2W.et##Mg2+#en#nombre#égaux#ainsi##la#
formule#brute#de#la#magnésie#est#MgO.#
#
d.#L’oxyde#de#sodium##est#un#solide#ionique#
renfermant#des#ions#sodium#et#des#ions#oxyde#O2W#
le#sodium#étant#situé#sur#la#première#colonne#du#
tableau#périodique,#il#possède#donc#un#seul#
électron#périphérique#qu’il#perd#facilement##pour#
former#l’ion#sodium#Na+##
l’oxyde#de#sodium#étant#électriquement#neutre#
doit#comporter#deux#ions#sodium#et#un#ion#oxyde#
afin#que#la#charge#totale#soit#nulle#et#donc#
#Formule#brute#de#l’oxyde#de#sodium#:#Na2O.#
!
#
1
/
1
100%