Correction du devoir maison de chimie

Correction du devoir maison de chimie
Exercice n°1 :
1) C : Z=6 H : Z=1 O :Z=8
En utilisant la formule de la molécule donnée dans l’énoncé :
6 n + 2 n +2 + 8 = 34 soit 8 n = ( 34 – 10 )
8 n = 24 d’où n = 3
La formule de la molécule est donc : C3H8O
2) L’équation-bilan équilibrée s’écrit :
2 C3H8O + 9 O2 6 CO2 + 8 H2O
Exercice n°2 :
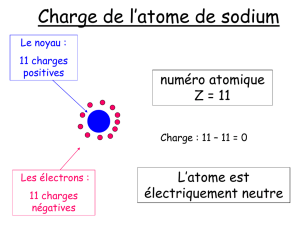
1) L’atome de sodium possède un numéro atomique de 11, il possède donc 11 électrons. Or
un atome est toujours électriquement neutre donc il possède 11 protons dans son noyau.
De plus il possède 23 nucléons :
n + 11 = 23
n = 12
Il possède donc 12 neutrons.
L’ion Na+ est un cation, il a donc perdu 1 électron.
En résumé, l’ion sodium possède :
- 10 électrons
- 11 protons
- 12 neutrons
2) On observe que mélectron mneutron et mélectron mproton donc :
mNa+ = 11 mproton + 12 mneutron
mNa+ = 23 1,67 10-27
mNa+ = 3,84 10 –26
La masse de l’ion sodium est égale à 3,84 10 –26 kg.
3) est en kg/m3
1 pm = 10-12 m
Les ions sont considérés comme des sphères. Le volume V d’une sphère est égal à :
V =
3
4
r
3
Na
où r
3
Na
est le rayon de l’ion sodium.
Ainsi :
Na+ =
312
26
)1097(
3
41084,3
Na+ 10044
La masse volumique de l’ion sodium est d’environ 10044 kg/m3

4) Le noyau est 100000 plus petit que l’ion donc :
rnoyau = 9,7 10-16 m.
noyau =
316
26
)107,9(
3
41084,3
noyau 1019
La masse volumique du noyau de l’ion sodium est d’environ 1019 kg/m3
5) noyau Terre
Exercice n°3 :
1) Ion Na+ : (K)2(L)8
Ion Cl- : (K)2(L)8(M)8
2) Il faut trouver l’atome qui possède 10 électrons : c’est l’atome de néon.
3) Il faut trouver l’atome qui possède 18 électrons : c’est l’atome d’argon.
4) Il faut trouver un cation qui possède 18 électrons : c’est le cation potassium de formule K+.
Exercice n°4 :
Pour dessiner la face n°1, on fait une vue en coupe de la situation :
Ion Na+
Ion Cl-
2) Pour les ions Na+ : dans le cube les ions Na+ occupent les 8 sommets et le milieu des 6
faces.
8
8
1
+ 6
2
1
= 4
Il y a donc 4 ions Na+ dans le cube.

Pour les ion Cl- : dans le cube les ions Cl- occupent le milieu de toutes les arêtes et le centre
du cube.
12
4
1
+ 1 = 4
Il y a donc 4 ions Cl- dans le cube. Le chlorure de sodium est bien sûr un composé
électriquement neutre.
3) Pour calculer la compacité du chlorure de sodium, il suffit d’appliquer la formule
proposée. Pour trouver le volume du cube on utilise une donnée de l’énoncé : « les ions
sodium et chlorure se touchent le long de l’arête du cube ».
Si on appelle a la longueur de l’arête du cube :
a = rNa+ + rCl- + rCl- + rNa+
a = 97 + 181 +181 + 97
a = 556
a= 556 pm
C =
3
33 )
3
4
3
4
(4
a
rr ClNa
C=
312
312312
)10556(
))10181()1097((
3
16
C = 0,667
La compacité du chlorure de sodium est de 0,667 ou 66,7 %, elle représente le taux
d’occupation du chlorure de sodium dans le cube.
1
/
3
100%