Chimie organique – Chapitre 3 : Stéréochimie de configuration

Document de cours
Lycée Hoche – BCSPT1A – A. Guillerand
Chimie organique – Chapitre 3 : Stéréochimie de configuration Page 1
Chimie organique – Chapitre 3 : Stéréochimie de configuration
I. Chiralité et énantiomérie
1. Chiralité
2. Énantiomérie
3. Atome de carbone asymétrique
II. Descripteurs stéréochimiques
1. Descripteurs de Cahn, Ingold et Prelog (CIP) : R et S et règle CIP
2. Cas de deux (ou plusieurs) atomes identiques de même rang
3. Cas de liaisons multiples
4. Cas particuliers des acides -aminés et des sucres : descripteurs D et L
III. Diastéréoisomérie
1. Définition
2. Molécules possédant deux carbones asymétriques
3. Cas particulier : composé méso
4. Cas de atomes de carbones asymétriques
5. Diastéréoisomérie cis-trans de la double liaison C = C – Stéréodescripteurs et
6. Diastéréoisomérie cis-trans des molécules cycliques
IV. Propriétés physiques et chimiques des énantiomères et des diastéréoisomères
1. Analyse documentaire
2. Retour sur les propriétés chimiques et biologiques de deux énantiomères
3. Activité optique des molécules chirales
V. Rôle de la diastéréoisomérie lors de synthèses énantiosélectives et de séparations d’énantiomères
Extrait du programme TS
Notions
Capacités exigibles
Chiralité : définition, approche historique.
Carbone asymétrique.
Chiralité des acides -aminés.
Énantiomérie, mélange racémique,
diastéréoisomérie (, deux atomes de
carbone asymétriques).
Reconnaître des espèces chirales à partir de leur représentation.
Identifier les atomes de carbone asymétrique d’une molécule donnée.
A partir d’un modèle moléculaire ou d’une représentation reconnaître
si des molécules sont identiques, énantiomères ou diastéréoisomères.
Pratiquer une démarche expérimentale pour mettre en évidence des
propriétés différentes de diastéréoisomères.
Extrait du programme de BCPST 1
Notions
Capacités exigibles
Carbone asymétrique, chiralité,
énantiomérie, diastéréoisomérie.
Descripteurs stéréochimiques Z/E,
R/S, D/L.
Activité optique, pouvoir
rotatoire, loi de Biot.
Mélange racémique.
Glucopyranoses, anomérie,
existence de la mutarotation du
glucose.
Déterminer si une molécule est chirale.
Identifier les relations de stéréoisomérie entre deux composés.
Comparer les propriétés de deux stéréoisomères de configuration, en milieu chiral
et non chiral.
Déterminer les descripteurs stéréochimiques dans les cas simples.
Utiliser la loi de Biot pour discuter de la pureté énantiomérique d’un mélange.
Illustrer l’importance de la structure spatiale par des exemples tirés du monde du
vivant. Approche documentaire : illustrer et analyser le rôle de la
diastéréoisomérie lors de synthèses énantiosélectives, de séparations
d’énantiomères et dans le monde du vivant.

Document de cours
Lycée Hoche – BCSPT1A – A. Guillerand
Chimie organique – Chapitre 3 : Stéréochimie de configuration Page 2
Introduction
Les origines de la stéréochimie de configuration remontent à la découverte par le physicien français Malus de la lumière
polarisée plane en 1809. Biot en 1812, suivant une observation antérieure d'Arago en 1811, découvre qu’une lame de
quartz, taillée perpendiculairement à l’axe de son cristal, fait tourner le plan de la lumière polarisée, mettant pour la
première fois en évidence la notion de pouvoir rotatoire.
C’est toutefois au génie de Pasteur que l’on doit l’extension de cette
découverte des cristaux aux molécules elles-mêmes, par l’analyse en 1848
des solutions du tartrate double de sodium et d’ammonium (figure 1) issus
de tonneaux de vins. En 1860, réalisant l’analogie entre cristaux et
molécules, Pasteur associe la propriété physique de faire tourner le plan de
polarisation de la lumière à la structure moléculaire : la possibilité de faire
tourner le plan de polarisation de la lumière est associée à une dissymétrie,
c’est-à-dire à une non identité du cristal ou d’une molécule avec son image
dans un miroir. Nous abordons dans ce chapitre la notion de molécule non superposable à son image dans un miroir, et
développons les conséquences physiques et chimiques.
Animation internet :
http://www.nathan.fr/upload/doccpg/172376_C14_anim_pasteur.swf
Définition :
Deux stéréoisomères de conformation diffèrent par rotation autour des liaisons simples.
La disposition spatiale des atomes d’un de ces stéréoisomères est appelée conformation.
Figure 2 : Différents stéréoisomères ayant la même formule plane
Connaître la configuration d’une molécule est capital pour comprendre ses propriétés physiques, chimiques et
biologiques. Voici quelques exemples de relation entre l’activité biologique de molécule et leur configuration.
Figure 3 : exemples de différences de propriétés biologiques liés à la différence de configuration
Figure 1 : Une des configurations du tartrate
double de sodium et d’ammonium

Document de cours
Lycée Hoche – BCSPT1A – A. Guillerand
Chimie organique – Chapitre 3 : Stéréochimie de configuration Page 3
I. Chiralité et énantiomérie
1. Chiralité
Définition :
Un objet non superposable à son image dans un miroir plan (appelée aussi image
spéculaire) est dit chiral.
Chiral vient du grec « cheir » la
main.La propriété d’un objet de
ne pas être superposable à son
image spéculaire existe à
l’échelle macroscopique (une
main droite, une chaussure
gauche, etc. sont des objets
chiraux), mais aussi à l’échelle
moléculaire.
2. Énantiomérie
Un objet et son image dans un miroir forment un couple, pour des molécules on parle
d’énantiomères.
Définitions :
On appelle énantiomère une des espèces moléculaire d’une paire qui sont images l’une
de l’autre dans un miroir et qui ne sont pas superposables.
Les deux espèces énantiomères d’un couple sont liées par une relation d’isomérie appelée
énantiomérie.
Des stéréoisomères de
configuration non image l’un de
l’autre dans un miroir plan sont
des diastéréoisomères.
Exercice d’application 1
Ce théorème n’est pas valable
pour les axes de symétrie. Une
molécule peut posséder un axe
de symétrie et être chirale.
Théorème très important :
Les molécules qui possèdent un plan de symétrie ou un centre de symétrie sont achirales.
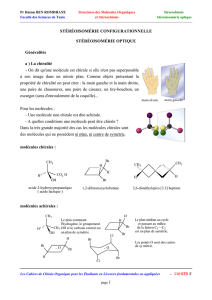
3. Atome de carbone asymétrique
En 1874, Van’t Hoff identifie qu’un atome de carbone dont la géométrie s’inscrit dans
un tétraèdre, liés à quatre atomes ou groupes différents d’atomes n’est pas superposable à
son image dans un miroir.
Définition :
On appelle atome de carbone asymétrique un atome de carbone tétraédrique lié à 4
atomes ou groupes différents d’atomes. Il est noté .
Exercice d’application 2, 3
Théorème :
Une molécule possédant un seul atome de carbone asymétrique est chirale. Elle est un
des deux énantiomères d’un couple.
Figure 4 : Représentation de Cram d’un bromochlorofluorométhane
et d’un butan-2-ol ainsi que leur image dans un miroir

Document de cours
Lycée Hoche – BCSPT1A – A. Guillerand
Chimie organique – Chapitre 3 : Stéréochimie de configuration Page 4
- Une molécule possédant plusieurs atomes de carbone asymétrique peut être achirale (si elle présente un
plan ou un centre de symétrie), cf.III.3.
- Des molécules ne possédant pas d’atomes asymétriques sont chirales, cf. exemples ci-dessous.
Le biphényle synthétisé pour la
première fois en 1922 par Christie et
Kenner. L’origine de la chiralité est
l’absence de libre rotation de la liaison
entre les deux cycles aromatiques en
raison de l’encombrement stérique des
groupes substituant les cycles.
L’hexahélicène a été synthétisé en
1056 par Newman et Lednicer. Ici,
l’origine de la chiralité est le sens de
rotation de la forme hélice de la
molécule.
En 1981, les cylclotrivératrylènes ont permis à A. Collet au collège
de France de synthétiser pour la première fois les cryptophanes,
molécules cages. Une représentation dans l’espace d’un
cylclotrivératrylène, le cyclotriguaiacylène A est proposé figure
suivante.
En raison de sa rigidité relative, le « chapeau » que constitue la
molécule ne peut pas s’inverser et par conséquent, l’image dans le
miroir de est non superposable.
Figure 7 : Les deux énantiomères du cyclotriguaiacylène
Cette molécule est donc chirale bien qu’elle possède un axe de symétrie de rotation d’ordre 3 : cela signifie que la
molécule est invariante par une rotation de autour de cet axe. Attention la non chiralité est imposée lors de la
présence d’un plan ou d’un centre de symétrie, un axe de symétrie n’impose pas de non chiralité.
Lors d’un léger chauffage, l’inversion du « chapeau » devient possible (on fournit suffisamment d’énergie pour franchir la
barrière de rotation). Le composé obtenu est alors superposable à l’énantiomère de . Par conséquent, en attendant
suffisamment longtemps, on observe une racémisation du milieu, jusqu’à disparition totale de l’activité optique de la
solution.
Figure 8 : Inversion conformationnelle du cyclotriguaiacylène
Figure 5 : Les deux énantiomères du biphényle et de l’ hexahélicène
Figure 6 : Structure du cyclotriguaiacylène

Document de cours
Lycée Hoche – BCSPT1A – A. Guillerand
Chimie organique – Chapitre 3 : Stéréochimie de configuration Page 5
II. Descripteurs stéréochimiques
1. Descripteurs de Cahn, Ingold et Prelog (CIP) : R et S et règle CIP
Voici la méthode pour différencier les deux configurations possibles d’un atome de carbone
asymétrique.
1 : les 4 substituants du carbone asymétrique sont classés par ordre décroissant de priorité
selon la règle CIP
Règle CIP 1: La priorité d’un atome augmente avec la valeur de son numéro atomique .
2 : on observe la molécule selon l’axe : substituant le moins prioritaire
3 :
- Si le sens de rotation 1-2-3 est celui des aiguilles d’une montre : stéréodescripteur
(rectus)
- Si le sens de rotation 1-2-3 est inverse de celui des aiguilles d’une montre :
stéréodescripteur (sinister)
4 : on place devant le nom de la molécule () ou () avec le numéro du carbone asymétrique si
nécessaire
2. Cas de deux (ou plusieurs) atomes identiques de même rang
On appelle rang (ou ordre) d’un atome par rapport à un centre asymétrique le nombre de
liaisons (simples ou multiples) qui les sépare.
Règle CIP 2 : Lorsque deux atomes directement liés au carbone asymétrique ont même
priorité, on classe, selon la règle précédente, les atomes qui leur sont liés (atomes dits de
second rang), on les compare deux à deux et ainsi de suite jusqu’à ce qu’on atteigne une
différence.
Sur l’exemple ci-contre, deux atomes attachés directement au carbone
asymétrique sont identiques, pourtant le carbone est bien
asymétrique. Il faut donc classer les atomes du rang supérieur et
comparer deux à deux les substituants.
Figure 9 : Un
stéréoisomère du
butanol
Exercices d’application
4, 5
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
1
/
15
100%