Sujet sciences physiques G2

1/4
L'épreuve comporte 5 exercices indépendants, répartis sur 4 pages numérotées de 1 à 4.
CHIMIE :
(8 points)
Exercice n°1(3,5points)
On introduit n
0
mol de tétraoxyde de diazote (N
2
O
4
: gaz incolore) à une température θ
1
dans un
récipient de volume fixe. Le tétraoxyde de diazote se dissocie au cours du temps en dioxyde d’azote
(NO
2
: gaz de couleur jaune brune) par la réaction endothermique symbolisée par l’équation
chimique suivante : N
2
O
4(g)
2 NO
2(g)
Lorsque l’équilibre s’établit :
-l’avancement final de la réaction est x
f
= 0,8 n
0
;
-la quantité de matière totale du système est
n
total =
1,08 mol.
1) a- Dresser le tableau descriptif d’évolution du système.
b-Déterminer la valeur du taux d’avancement final τ
f
de la réaction.
c-Déterminer les valeurs de n
0
et de x
f
.
2) On maintient la même pression du système et on modifie la température. Pour une valeur
θ
2
de
la température, un nouvel état d’équilibre s’établit lorsque l’avancement de la réaction devient
x’
f
= 0,36 mol.
a- Préciser, en justifiant, si la couleur jaune brune du mélange gazeux devient plus intense ou
moins intense.
b - Comparer, en justifiant, θ
1
et θ
2
.
c -Déterminer la nouvelle composition du mélange à l’équilibre.
3) On augmente la pression du système à température constante. Préciser, en justifiant, si la couleur
jaune brune du mélange gazeux s’intensifie ou s’affaiblit.
Exercice n°2(4,5points)
Toutes les solutions sont prises à 25°C, température à laquelle le produit ionique de l'eau pure est Ke =10
-14
.
En dissolvant chacun des trois acides A
1
H, A
2
H et A
3
H dans l'eau pure, on prépare respectivement
trois solutions acides (S
1
), (S
2
) et (S
3
) de concentrations molaires initiales respectives Ca
1
, Ca
2
et
Ca
3
et de pH respectifs pH
1
=3,9 ; pH
2
=3 et pH
3
=3.
1) On réalise ensuite trois dosages en ajoutant progressivement la même solution d’hydroxyde de
sodium (NaOH) de concentration C
b
à un volume V
a
=10 mL de chacune des solutions (S
1
), (S
2
) et
(S
3
).
Les volumes de solution d’hydroxyde de sodium versés à l’équivalence sont respectivement
V
bE1
=10 mL; V
bE2
=16mL et V
bE3
=10mL.
a- Montrer que les solutions acides (S
1
) et (S
3
) ont la même concentration molaire.
b- En déduire que le monoacide A
3
H est plus fort que le monoacide A
1
H.
2)a- Trouver une relation entre Ca
2
et Ca
3
.
b- En déduire, parmi A
1
H, A
2
H et A
3
H, le monoacide le plus fort.
Université De Monastir
Concours de Réorientation Session 2016
ا
ةرود ا ةدإ ةظ2016
Epreuve de Sciences Physiques (groupe N°2)
Durée : 2 Heures Coefficient : 1

2/4
3) Montrer que le pH d’une solution aqueuse de monoacide faible AH faiblement ionisée et de pH
inferieur à 6 est lié à la concentration C de la solution et au pKa du couple AH/A
-
par la relation
logC)(pKa
2
1
pH −=
4)
On dilue dix fois chacune des solutions (S
1
), (S
2
) et (S
3
). On obtient ainsi trois nouvelles
solutions (S’
1
),(S’
2
) et (S’
3
) .On trouve successivement
pH’
1
=4,4
;
pH’
2
=3,5
et
pH’
3
=4
.
a-
Montrer en justifiant, lequel des trois monoacides A
1
H, A
2
H et A
3
H est un monoacide fort.
Calculer sa concentration molaire.
b-
En déduire la concentration molaire
C
b
de la solution basique utilisée.
c-
Déterminer, alors, les concentrations initiales des deux autres acides.
d-
En déduire les
pKa
des couples auxquels appartiennent les deux acides faibles.
PHYSIQUE :
(12 points)
Exercice n°1(3,5points)
Un circuit électrique est constitué par l'association en série d'un générateur de tension idéal de force
électromotrice
E = 6 V
, d'une bobine d'inductance L et de résistance interne r, d'un conducteur
ohmique de résistance
R=50Ω
et d'un interrupteur K. (figure 1).
Afin de visualiser simultanément les tensions
u
1
(t)
aux bornes du conducteur ohmique et
u
2
(t)
aux
bornes de la bobine, on réalise les connexions adéquates à un oscilloscope bicourbe et on ferme
l'interrupteur K à un instant choisi comme origine des temps (t = 0s).Les courbes traduisant les
variations de
u
1
(t)
et
u
2
(t)
sont celles de la figure 2.
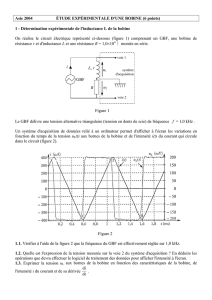
.
1)a-
Montrer que la tension u
1
(t) aux bornes du résistor est régie par l’équation différentielle
L
E
Ru
τ
1
dt
du
1
1
=+
où
r
R
L
τ
+
=
b-
La solution d’une telle équation différentielle est de type u
1
(t) = A e
-kt
+ B.
Trouver l’expression de u
1
(t) en fonction de r, R, L et E sachant qu’à t=0s l’intensité du courant i est
nulle. On précisera en particulier l’expression de
k
.
2)a-
Déterminer la valeur
I
0
de i(t) en régime permanent. En déduire la valeur de la résistance
r
de
la bobine.
b-
Déterminer graphiquement la valeur de la constante de temps
τ
. En déduire la valeur de
l’inductance
L
de la bobine.
1 2 3 4 5 6 7 8 9 10 11
0
1
2
3
4
5
6
t en ms
Tension en V
Courbe (1)
Courbe (2)
Figure 2
Figure 1
u
1
L,r
K
u
2
R
E
i
A

3/4
3) Sachant que la solution de l'équation différentielle précédente est
)eE(1
r
R
R
)(u t
-
1
τ
−
+
=
t
.
a-Montrer que la tension u
2
(t) aux bornes de la bobine s'écrit : beatu +=
−τ
t
2
.)( où a et b sont
des constantes dont on déterminera les valeurs.
b-Vérifier que
5
b
a=. En déduire que la valeur de la résistance interne de la bobine est r=10Ω.
c-
Calculer la valeur de l’énergie magnétique emmagasinée
E
L
dans la bobine lorsque
u
1
=u
2
Exercice n°2(5points)
On associe en série, un conducteur ohmique de résistance
R = 200
Ω, un condensateur de capacité
C
et une bobine d'inductance
L = 1,1 H
et de résistance interne négligeable. L'ensemble est alimenté
par un générateur basse fréquence (GBF) délivrant à ses bornes une tension alternative sinusoïdale
u(t) = U
m
sin(2
π
Nt), d'amplitude U
m
constante et de fréquence N réglable. (figure 1).
A l'aide d'un oscilloscope bicourbe, convenablement branché, on visualise simultanément les
variations, en fonction du temps, des tensions
u(t)
aux bornes du générateur et
u
C
(t)
aux bornes du
condensateur.
1)
Pour une valeur N
1
de la fréquence N de la tension délivrée par le GBF, on obtient les
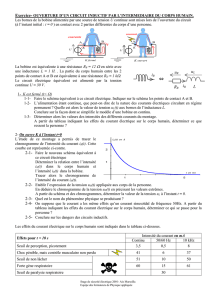
oscillogrammes de la figure 2, avec les réglages suivants :
- la sensibilité verticale est la même pour les deux voies : 2 V.div
-1
;
- le balayage horizontal est : 1 ms.div
-1
.
Déterminer graphiquement :
a-
la fréquence
N
1
de la tension u (t) ;
b-
les tensions maximales
U
m
de u(t) et
U
Cm
de u
C
(t) ;
c-
le déphasage
uCu
ϕϕϕ
−=
∆.
d-
Préciser, en justifiant la réponse, la nature du circuit (inductif, capacitif ou résistif).
figure 2
D
figure 1 figure 1
L
C R
GBF

4/4
2) A partir de la fréquence N
1
on fait varier la fréquence N de la tension u(t). Pour une valeur N
2
de
N, la tension u
C
(t) devient en quadrature retard de phase par rapport à u(t). Un voltmètre, branché
aux bornes de la bobine, indique une tension U
L
= 20V.
a- Montrer que le circuit est le siège d'une résonance d'intensité.
b- Calculer la valeur de l'intensité efficace I
0
du courant qui circule dans le circuit.
c- Déterminer la valeur de la fréquence N
2
.
d- Calculer la valeur de la capacité C du condensateur.
3) L’équation différentielle régissant les variations de l’intensité du courant circulant dans le circuit
RLC série peut s’écrire :
u(t)dt (t)i
c
1
dt
i(t) d
L (t) i R =++
∫
a- Montrer que
2
Riu.i
dt
dE −= , où E désigne l’énergie totale de l’oscillateur RLC et i désigne
l’intensité instantanée du courant.
b-
En déduire que
E
prend à la résonance d’intensité une valeur constante qu’on calculera.
Exercice n°3 (3,5points)
Données :
Célérité de la lumière dans le vide : c = 3.10
8
m.s
– 1
.
Électronvolt : 1 eV est équivalent à 1,6022.10
– 19
J.
Unité de masse atomique : 1 u vaut 1,6605.10
– 27
kg et son énergie est de 931,5 MeV.
Masses (en u) :
proton neutron électron
U
235
92
Sr
94
38
Xe
140
54
mp =1,0073 mn = 1,0087 me = 5,486.10
–
4
234,9935 93,8945 139,8920
On considère le noyau d'uranium 235 de symbole
U
235
92
.
1) a-
Donner la définition de l'énergie de liaison d’un noyau.
b-
Déterminer la valeur de l'énergie de liaison du noyau
U
235
92
ainsi que son énergie de liaison par
nucléon.
2)
Sous l'impact d'un neutron, un noyau d'uranium 235 peut subir une fission, dont les produits sont
le strontium 94 de symbole
Sr
94
38
et le xénon 140 de symbole
Xe
140
54
.
a-
Ecrire l’équation de cette réaction de fission en précisant les lois de conservation qui la
régissent.
b-
Calculer l'énergie libérée par cette réaction de fission.
3)
On considère la réaction de fusion nucléaire suivante H2HeHeHe
1
1
4
2
3
2
3
2
+→+
a-
Donner la définition de la fusion nucléaire.
b-
La perte de masse correspondant à cette fusion est
∆
m = 0,00137 u.
Calculer l'énergie libérée lors de cette réaction de fusion.
1
/
4
100%