Etude expérimentale d`une bobine 6pts

TERMINALES S – DS n°4
Exercice 1 : Etude expérimentale d’une bobine ( 10 points ) ( 55 minutes )
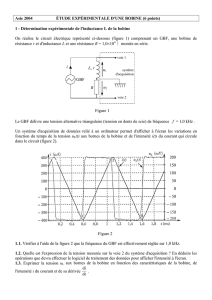
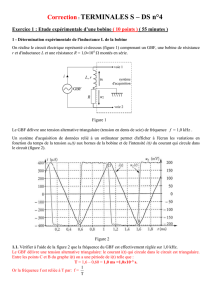
1 - Détermination expérimentale de l'inductance L de la bobine
On réalise le circuit électrique représenté ci-dessous (figure 1) comprenant un GBF, une bobine de résistance
r et d'inductance L et une résistance R = 1,0104 montés en série.
Le GBF délivre une tension alternative triangulaire (tension en dents de scie) de fréquence f = 1,0 kHz .
Un système d'acquisition de données relié à un ordinateur permet d'afficher à l'écran les variations en
fonction du temps de la tension uL(t) aux bornes de la bobine et de l'intensité i(t) du courant qui circule dans
le circuit (figure 2).
1.1. Vérifier à l'aide de la figure 2 que la fréquence du GBF est effectivement réglée sur 1,0 kHz.
1.2. Quelle est l'expression de la tension mesurée sur la voie 2 du système d'acquisition ? En déduire les
opérations que devra effectuer le logiciel de traitement des données pour afficher l'intensité à l'écran.
1.3. Exprimer la tension uL aux bornes de la bobine en fonction des caractéristiques de la bobine, de
l'intensité i du courant et de sa dérivée
dt
di
.
R
L, r
u1
u2
GBF
i
voie 1
voie 2
Figure 1
système
d'acquisition
Figure 2

1.4.1. Sur la figure 2, la représentation graphique de la fonction i(t) montre qu'en réalité, les crêtes de
l'intensité sont arrondies. Dans ces conditions, la tangente au sommet est horizontale.
En déduire une expression simplifiée de uL quand l'intensité dans le circuit est extrémale.
A la lecture de i(t) pour t = 1,6 ms, que peut-on dire de r ?
1.5. On néglige dans la suite le terme faisant intervenir r dans l'expression de uL ainsi que les arrondis des
crêtes de l'intensité.
À partir de la demi-période comprise entre les points C et D de la figure 2, mesurer uL , calculer
dt
di
et en
déduire la valeur de L.
2 - Constante de temps d'un circuit RL
En réalité, la valeur de r est de 12 .
La bobine est maintenant montée en série avec une résistance R' = 100 aux bornes d'un générateur idéal de
tension de f.e.m. E = 6,5 V (figure 3).
Le système d'acquisition permet de suivre l'évolution de l'intensité du courant dans le circuit en fonction du
temps. La fermeture de l'interrupteur à l'instant t = 0 déclenche l'acquisition. L'enregistrement obtenu est
représenté sur la figure 4.
R'
L, r
K
u
i
système
d'acquisition
de données
Figure 3
E
(ms)
t
0
1
2
3
4
5
6
7
i(t)
(mA)
10
20
30
40
50
60
I en régime permanent
Figure 4

2.1. Établir l'expression donnant l'intensité du courant en régime permanent en fonction des caractéristiques
du circuit.
2.2. Vérifier que la valeur de l'intensité du courant en régime permanent obtenue sur le graphe de la
figure 4 est en accord avec les données de l'énoncé.
2.3.1. Rappeler l'expression de la constante de temps d'un dipôle RL.
2.3.2. Déterminer graphiquement sa valeur en faisant figurer la méthode utilisée sur la figure 5 en annexe à
rendre avec la copie.
2.4. La résistance R' est en réalité une résistance réglable. On lui donne maintenant la valeur 150 .
2.4.1. Calculer la nouvelle intensité du courant en régime permanent.
2.4.2. Calculer la constante de temps du nouveau dipôle RL.
2.4.3. Représenter avec soin la courbe représentant l'évolution de l'intensité du courant en fonction du temps
i = f(t) sur la figure 5 en annexe, à rendre avec la copie.
Vous utiliserez une couleur différente pour cette nouvelle courbe et prendrez soin d’utiliser les calculs des
questions 2.4.1 et 2.4.2 .
Figure 5
(ms)
t
0
1
2
3
4
5
6
7
i(t)
(mA)
10
20
30
40
50
60
I en régime permanent

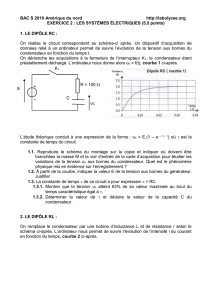
Exercice 2 : Dipôles RC et RLC ( 5,5 points ) ( 35 minutes )
On considère le circuit électrique comportant un générateur de tension continue de f.é.m E = 6 V, un
condensateur de capacité C, une bobine d'inductance L et de résistance négligeable, deux conducteurs
ohmiques de résistance R et deux interrupteurs K et K’(voir figure 1).
On utilise un dispositif informatisé d'acquisition de données qui permet de visualiser sur la voie 1 la tension
u1 aux bornes du condensateur en fonction du temps.
A – Première expérience
Dans cette expérience, on ferme K (en maintenant K’ ouvert). Le dipôle (R,C) est alors soumis à un échelon
de tension de valeur E.
1. Quel est le nom du phénomène observé sur la voie 1 à la fermeture de K ?
2. Reproduire sur la copie la partie de circuit concernée et indiquer sur ce schéma, juste après la fermeture de
l’interrupteur K, le sens du courant, le signe des charges de chacune des armatures du condensateur.
Indiquer la flèche-tension u1 aux bornes du condensateur.
3. Sur la voie 1, on obtient la courbe de la figure 2 ci-dessous
Déterminer graphiquement, la constante de temps du dipôle (R,C) en expliquant la méthode utilisée.
Sachant que R = 20 , en déduire la valeur de la capacité C.
4. L'étude théorique du dipôle(R,C) conduit à l’équation différentielle
Error!
+ u1 = E .

a) Retrouver cette équation différentielle en appliquant la loi d'additivité des tensions
b) Compte tenu des conditions initiales, la solution de cette équation est de la forme
u1 = E .
t
e1
. Calculer la valeur de u1 pour t = 5. Conclure.
B – Deuxième expérience
Une fois la première expérience réalisée, on ouvre K puis on ferme K’. Le circuit est alors le siège
d'oscillations électriques. On utilise le mène dispositif informatisé d'acquisition de données pour visualiser,
sur la voie 1, la tension u1 aux bornes du condensateur et sur la voie 2, la tension u2 aux bornes du conducteur
ohmique R. L'acquisition est synchronisée avec la fermeture de l'interrupteur. On obtient les courbes de la
figure 3 :
1. Attribuer à chaque courbe de la figure 3 la tension correspondante en justifiant brièvement pour une courbe
seulement.
2. Mesurer la pseudo-période T des oscillations. Calculer la période propre correspondant au cas où les
résistances R sont négligeables. Conclure.
Exercice 3 : Dosage pH-métrique de l'acide ascorbique contenu dans un comprimé de
vitamine C ( 4,5 points ) ( 25 minutes )
Un comprimé de vitamine C non tamponnée contient de l'acide ascorbique C6H806 que l'on se propose de
doser. l'acide ascorbique, dont la masse molaire est 176 g.mol-1, a pour base conjuguée l'ion ascorbate.
À 25° C, le pKa du couple acide ascorbique/ion ascorbate est 4,2. On note ce couple AH/A- par
commodité… On rappelle aussi la valeur du pKe qui est de 14.
On dissout le comprimé de vitamine C dans de l'eau distillée de manière à obtenir 200 mL de solution S. On
prélève 50,0 ml de solution S et on procède au dosage pH-métrique par une solution de soude ( contenant les
ions hydroxydes HO- ) de concentration molaire apportée cB = 2,00 . 10-2 mol·L-1. On trace la courbe pH =
f(vB) , reproduite document 1, où vB désigne le volume de soude versé.
Partie A
A.1. Écrire l'équation chimique associée à la transformation du système chimique .
 6
6
1
/
6
100%