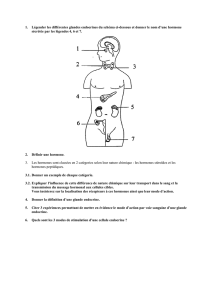
métabolisme des hormones stéroïdes et thyroïdiennes

MÉTABOLISME DES HORMONES STÉROÏDES ET THYROÏDIENNES
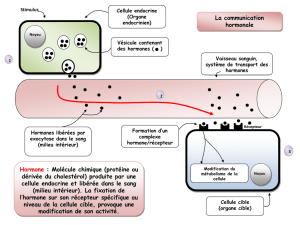
Ces deux catégories d’hormones possèdent des récepteurs spécifiques
intracellulaires ; ceux-ci sont activés après liaison de l’hormone, ils vont alors se
localiser sur l’ADN où ils modulent la transcription de gènes-cibles. La liaison à l’ADN
se fait au niveau de régions spécialisées (éléments de réponse à l’hormone).
• Définitions et règles de nomenclature des hormones stéroïdes
Hormones ayant toutes, pour origine, le cholestérol. Elles sont produites par deux
types de glandes endocrines : les corticosurrénales et les gonades.
Une hormone stéroïde particulière ne sera pas abordée ici, le dérivé biologiquement
actif de la vitamine D3 (voir métabolisme phosphocalcique).
Trois types de noyau stérane sont à la base des grandes familles d’hormones
stéroïdes :
• Œstrane (18 C) : --> œstrogènes
• Androstane (19 C) : --> androgènes
• Prégnane (21 C) : --> progestérone et corticostéroïdes
Les cycles voisins sont en configuration trans l’un par rapport à l’autre, chaque cycle
ayant une conformation chaise. Les cycles A et B peuvent cependant prendre deux
configurations pour les catabolites.
La grande majorité des catabolites adoptent la configuration cis ; ils ne peuvent pas
se lier au récepteur de l’hormone et sont donc inactifs.
Les catabolites des androgènes prennent, eux, souvent la configuration trans, proche
de la configuration des hormones actives. Ceci leur permet de se lier au récepteur de
l’hormone et donc de conserver une certaine activité biologique.
I/ BIOSYNTHESE DES HORMONES STÉROÏDES
I.1. Origines du cholesterol et mecanisme d’action des enzymes
I.1.1. Origines du cholestérol
Le cholestérol utilisé pour la biosynthèse a deux origines :
• Cholestérol endogène circulant : LDL (*Low Density Lipoproteins*) et HDL
(*High Density Lipoproteins*) du plasma sanguin (contrairement à la plupart
des cellules de l’organisme, les cellules synthétisant les hormones stéroïdes
utilisent aussi les HDL).
• Cholestérol synthétisé in situ dans la glande endocrine.
I.1.2. Mécanisme d'action des enzymes :
a) Hydroxylases (ou mono-oxygénases) et Desmolases (ou Lyases) :
Elles utilisent une minichaîne d’oxydoréduction contenant 3 ou 4 facteurs et de
l’oxygène.
La protéine Fe.S est l’adrénoxine. Comme son nom le suggère, cette protéine est
présente dans les surrénales mais absente des gonades.
b) Déshydrogénases (HSD) (* HydoxyStéroïdeDéshydrogénases*) :
Enzymes à action réversible utilisant le NAD ou le NADP.

2
I.2. Etapes communes
- dans les mitochondries : prégnènolone
Deux hydroxylations successives du cholestérol par les 20- et 22- hydroxylases.
Puis coupure entre les C20 et C22 par une desmolase.
La 20-22 desmolase est une enzyme-clé dans la régulation : activée par l’ACTH
dans la cortico. ou par la LH dans les gonades.
- dans le réticulum endoplasmique : androgènes
Action de 3 enzymes : 3β-HSD, 17-hydroxylase et 17-20 desmolase
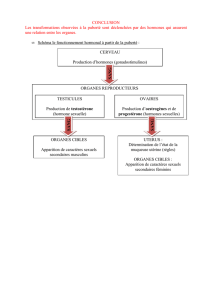
I.3. Cortex surrénal
En plus des enzymes déjà vues, le cortex surrénal possède des enzymes
spécifiques à l’origine de la synthèse des hormones corticosurrénaliennes. La voie
de synthèse suivie diffère selon la localisation dans le cortex :
• Zones interne et surtout médiane (réticulée et fasciculée) : présence de
21 et 11β hydroxylases permettant la synthèse de corticostérone et cortisol, ce
dernier est aussi appelé « hydrocortisone » (ce sont les glucocorticoïdes).
La zone réticulée en contient moins. Elle synthétise donc davantage
d’androgènes.
• Zone externe (glomérulée) : présence en plus d’une 18 hydroxylase et d’une
18β-HSD permettant la synthèse d’aldostérone (minéralocorticoïdes). Cette
voie est par ailleurs favorisée par une activité 17-hydroxylase très faible.
Les productions des principales hormones diffèrent beaucoup entre elles
(*N2A : Cortisol (50 µmol/j) ; corticostérone (5 µmol/j) ; aldostérone (0,5 µmol/j)*).
Les principales hormones sécrétées dans le sang sont : le cortisol, la corticostérone,
le sulfate de DHA (ou DHEA), (*5’-DéHydroEpiAndrostérone*), l’aldostérone.
Le cortisol plasmatique est l’hormone la plus fréquemment dosée en biologie
clinique. Sa concentration est déterminée à une heure précise car la cortisolémie
varie au cours de la journée :
Valeur de réf. : Cortisol pl à 8h du matin : 275 – 550 nmol/l (100 – 200 µg/l)
.
Les glucocorticoïdes sécrétés sont transportés dans le plasma sanguin surtout par
une protéine spécifique : la transcortine ou « CBG : Corticosteroid-Binding
Globulin ».
I.4. Testicules
Les cellules de Leydig contiennent les mêmes enzymes que celles des étapes
communes + une enzyme spécifique des gonades : la 17β-HSD (enzyme localisée
dans le reticulum endoplasmique). Le métabolisme de la prégnènolone est donc
entièrement dirigé vers les androgènes.

3
*N2A :
• Une partie de la testostérone produite passe directement dans les tubes
séminifères et le tractus génital : transport par une protéine spécifique : l’ABP
(« Androgen Binding Protein »). La testostérone y contribue au maintien de la
spermatogénèse et à l’activation des spermatozoïdes.
• Chez le garçon, avant la puberté, l’activité 17β-HSD est très faible, il y a donc
sécrétion surtout d’androstènedione, en quantité d’ailleurs très réduite (origine
essentiellement corticosurrénalienne). *
I.5. Ovaires
I.5.1. Localisation tissulaire
Elle est différente selon la période du cycle.
Avant l’ovulation, le follicule ovarien synthétise et sécrète de l’œstradiol :
L’œstradiol est synthétisé par les enzymes de la thèque interne.
La granulosa possède, elle, un équipement enzymatique incomplet qui ne permet
que la synthèse de progestérone. Celle-ci ne peut cependant pas être sécrétée dans
le sang : elle n’est pas vascularisée et la progestérone doit donc passer à travers les
thèques ce qui entraîne sa transformation en œstradiol.
Après l’ovulation, la granulosa se retrouve en position externe et peut sécréter la
progestérone dans le sang. Elle se vascularise et se transforme en corps jaune. Par
ailleurs, ce dernier acquiert les enzymes permettant la synthèse d’œstradiol : on
observe donc, dans la 2e partie du cycle, la sécrétion de progestérone et une
augmentation de la sécrétion d’œstradiol.
La stroma ovarien produit et sécrète, lui, en très faible quantité, de
l’androstènedione.
(*N2 :Cette production peut, dans des cas d’hyper développement pathologique du
stroma, provoquer un syndrome de virilisation : syndrome de Stein-Leventhal.*)
I.5.2. Progestérone et œstrogènes
cf. étapes communes pour la synthèse d’androgènes.
Un complexe enzymatique spécifique constitué de trois enzymes (enzymes
d’aromatisation) permet la synthèse d’œstrogènes à partir de l’andostènedione.
Remarque : La 17β-HSD peut agir aussi en début de chaîne métabolique : les
enzymes d’aromatisation agissent alors sur la testostérone et non sur
l’androstènedione.
II. CATABOLISME DES HORMONES STÉROÏDES
• Localisation, conjugaison et élimination
Après sécrétion dans le sang, les hormones sont transportées dans le plasma, le
plus souvent par une protéine spécifique. Elles entrent facilement dans les
différentes cellules de l’organisme (grâce à leurs propriétés hydrophobes) et agissent
dans les cellules où se trouve un récepteur spécifique (cellules-cibles).
Le catabolisme de l’hormone est ensuite réalisé, le plus souvent, dans la cellule-cible
elle-même, mais aussi dans le foie.

4
Les catabolites sont conjugués dans le foie : il s’agit d’une condensation avec un
acide : acide glucuronique ou sulfurique, molécules acides qui sont apportées sous
forme activée avec un nucléotide (UDP-glucuronate, PAPS).
Cette condensation s’effectue entre une fonction alcoolique du stéroïde et :
• Soit, surtout, la fonction semi-aldéhydique de l’acide glucuronique
--> glucuronide (ou glucosiduronate)
• Soit une fonction acide de l’acide sulfurique
Rendus ainsi hydrophiles, les catabolites conjugués sont éliminés dans les urines où
certains sont dosés (exception : œstrogènes dont une partie est éliminée dans les
selles).
II.1. Progestérone
Série de 3 réductions successives :
• En 5 (β surtout) --> DHD (DiHydroDérivés)
• En 3 (α surtout) --> THD (TétraHydroDérivés)
• En 20 (α surtout) --> HHD (HexaHydroDérivés)
La conjugaison se fait sur la fonction alcoolique qui apparaît après la réduction en 3
(donc : THD et HHD).
Le catabolite final est le prégnandiol (HHD) mais on trouve aussi dans les urines des
THD.
II.2. Cortisol
Le catabolisme est effectué sur le cortisol et sur son dérivé oxydé en 11β (par une
11β-HSD) : la cortisone (dérivé inactif).
II.2.1. 17-Hydroxystéroïdes :# 60%
- Obtenus par réductions successives comme le prégnandiol, en 5, 3 puis 20.
(*N2A : THD = 25% ; HHD = 35% *).
Conjugaison par l’acide glucuronique.
II.2.2. 17-0xostéroïdes : # 3%
- Obtenus par action de la desmolase C17-20 sur les HHD du cortisol et de la
cortisone.
II.2.3. Cortisol libre : < 1%
- Hormone retrouvée non modifiée dans les urines. Il est intéressant à doser car il
reflète le cortisol plasmatique libre (non lié aux protéines de transport du plasma)
donc biologiquement actif (capable de pénétrer dans les cellules).
II.2.4. 6β-Hydroxycortisol :< 1%
- Obtenu par l’action d’une 6β-hydroxylase hépatique. L’activité de cette enzyme
augmente lors d’intoxications et lors de la grossesse.
II.3. Aldostérone
II.3.1. THD et HHD glucuronoconjugués :> 50%
II.3.2. Aldostérone glucuronoconjuguée : 5 – 10%
La conjugaison sans réduction préalable est possible grâce à la structure particulière
de ce stéroïde : elle se fait avec le groupement « OH » présent sur le carbone 18.
C’est le métabolite le plus dosé car il est, par définition, très spécifique.

5
II.4. Androgènes
Le sulfate de DHEA est partiellement excrété tel quel dans les urines (* 1 à 20% *).
Le reste est hydrolysé dans le foie par une sulfatase.
À la différence des autres hormones stéroïdes, les androgènes sont surtout réduits
en 5α (et non 5β). Les cycles A et B des catabolites sont donc en position trans (cf.
introduction sur les règles de nomenclature) et sont encore capables de se lier au
récepteur de l’hormone active. Ils conservent, de ce fait, une activité hormonale, bien
que réduite.
II.5. Oestrogènes
A la différence des autres hormones stéroïdes, les œstrogènes ne sont pas réduits
mais subissent l’action de différentes hydroxylases agissant surtout sur le C2 et le
C16 (accessoirement : C4, C15).
Les modalités de conjugaison sont complexes. Il se forme des polyconjugués
excrétés en quantité relativement élevée dans la bile.
L’œstriol est, lui, produit surtout pendant la grossesse (16α-hydroxylase du foie du
foetus). Il est excrété directement dans les urines, grâce à son caractère hydrophile.
Son dosage dans les urines constitue un test de viabilité fœtale.
II.6. Catabolites dosés en biologie clinique :
Ils seront étudiés, au 2e semestre, dans l’ECI 4.
*N2 : Les dosages couramment réalisés en biologie clinique dans les urines sont :
• 17-hydroxystéroïdes et cortisol libre : exploration des glucocorticoïdes
• aldostérone glucurono-conjuguée : exploration des minéralocorticoïdes
• 17-oxostéroïdes : exploration des androgènes
• Dans une moindre mesure, l’œstriol lors d’une grossesse pathologique.*
III / MÉTABOLISME DES HORMONES THYROÏDIENNES
III. 1. Biosynthèse
Les hormones thyroïdiennes sont des dérivés iodés d’acides aminés dérivés de la
tyrosine. Elles sont les principales molécules organiques iodées de l’organisme.
Les iodures utilisés sont captés à partir du plasma par la glande thyroïde grâce à un
mécanisme de transport actif. Une fois captés, ils sont immédiatement transformés
en iode organique :
2 I- + H2O2 + 2 H+ ------Æ 2 I° (iode radicalaire) + 2 H2O
thyroperoxydase
1) Greffe de I° sur des résidus Tyr d’une grosse protéine : la thyroglobuline
Æ MIT (*MonoIodoTyrosine*) Æ DIT (*DiIodoTyrosine*)
2) Condensation entre 2 DIT Æ T4
entre DIT et MIT Æ T3 + résidu Alanyl
3) Passage possible de T4 à T3 par une désiodase
La thyroglobuline est ensuite incorporée dans des lysosomes où elle est dégradée
Æ libération de T4 et T3 dans le sang
 6
6
1
/
6
100%